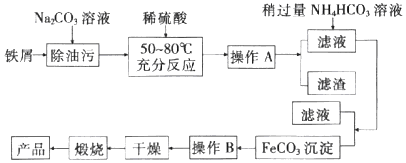
��Ŀ����
����Ŀ��CO�����ںϳɼ״�����ѧ����ʽΪCO��g����2H2��g��![]() CH3OH��g����
CH3OH��g����
��1�� ͼ1�Ƿ�ӦCO��g����2H2��g��![]() CH3OH��g���ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�
CH3OH��g���ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�

�ٸ÷�Ӧ���ʱ䦤H________0���>����<����������
��T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1________K2���>������<������������T1�¶��£������Ϊ1 L���ܱ������У�����1 mol CO��2 mol H2�������CO��CH3OH��g����Ũ����ʱ��仯��ͼ2��ʾ����÷�Ӧ��ƽ�ⳣ��Ϊ______________��

���������ݻ����䣬���д�ʩ������COת���ʵ���________������ĸ����
a�������¶� b����CH3OH��g������ϵ�з���
c��ʹ�ú��ʵĴ��� d������He��ʹ��ϵ��ѹǿ����
��2�� ���ݻ�Ϊ1 L�ĺ��������У��ֱ��о���230 ����250 ���270 �������¶��ºϳɼ״��Ĺ��ɡ���ͼ3�����������¶���H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1 mol����COƽ��ת���ʵĹ�ϵ��������z��Ӧ���¶���________�棻���¶���������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________��������a��b��c���Ӧ�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2��K3����K1��K2��K3�Ĵ�С��ϵΪ________________________��

���𰸡� < > 12 b 270 4 K1��K2<K3
��������������������⿼�黯ѧƽ��ͼ��ķ�������ѧƽ�ⳣ���ļ����Լ��¶ȶԻ�ѧƽ�ⳣ����Ӱ�죬��������Ի�ѧƽ���Ӱ����
��1������ͼ���֪��T2�ȳ��ֹյ㣬��T2��Ӧ���ʿ죬T2![]() T1��T2ƽ��ʱCOת����С��T1ƽ��ʱCOת���ʣ������¶�ƽ�����淴Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����H
T1��T2ƽ��ʱCOת����С��T1ƽ��ʱCOת���ʣ������¶�ƽ�����淴Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����H![]() 0��
0��
���������ķ������¶�T2![]() T1������ӦΪ���ȷ�Ӧ���¶ȸ�ƽ�ⳣ��С��K1
T1������ӦΪ���ȷ�Ӧ���¶ȸ�ƽ�ⳣ��С��K1![]() K2��
K2��
����ͼ���г�����ʽ��
CO��g����2H2��g��![]() CH3OH��g��
CH3OH��g��
c����ʼ����mol/L�� 1.00 2.00 0
c��ת������mol/L�� 0.75 1.5 0.75
c��ƽ�⣩��mol/L�� 0.25 0.5 0.75
�÷�Ӧ��ƽ�ⳣ��Ϊ![]() =12��
=12��
��a������¶���ƽ�����淴Ӧ�����ƶ���CO��ת���ʼ�С��b������CH3OH��g������ϵ�з�����ƽ��������Ӧ�����ƶ���CO��ת��������c�ʹ�ú��ʵĴ�������ѧƽ�ⲻ�ƶ���CO��ת���ʲ��䣻d��������He��ʹ��ϵ��ѹǿ���������������ݻ����䣬������Ũ�Ȳ��䣬��ѧƽ�ⲻ�ƶ���CO��ת���ʲ��䣻��ѡb��
��2���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���CO��ת���ʼ�С���ں���������ȡһ����������Ĵ�ֱ�ߣ��ɼ�CO��ת���ʣ�x![]() y
y![]() z����x��y��z��Ӧ���¶�����Ϊ230����250����270����z���߶�Ӧ���¶���270������ͼ֪���¶�����ʼn(H2)/n(CO)=1.5����ʼH2��CO���ʵ����ֱ�Ϊ1.5mol��1mol�����ﵽƽ��ʱCO��ת����Ϊ50%��������ʽ
z����x��y��z��Ӧ���¶�����Ϊ230����250����270����z���߶�Ӧ���¶���270������ͼ֪���¶�����ʼn(H2)/n(CO)=1.5����ʼH2��CO���ʵ����ֱ�Ϊ1.5mol��1mol�����ﵽƽ��ʱCO��ת����Ϊ50%��������ʽ
CO��g����2H2��g��![]() CH3OH��g��
CH3OH��g��
c����ʼ����mol/L�� 1 1.5 0
c��ת������mol/L�� 1![]() 50%=0.5 1 0.5
50%=0.5 1 0.5
c��ƽ�⣩��mol/L�� 0.5 0.5 0.5
���¶��µĻ�ѧƽ�ⳣ��Ϊ![]() =4��a��b����¶���ͬ����K1=K2��c���¶ȵ���a��b�㣬�¶�����ƽ�����淴Ӧ�����ƶ�����ѧƽ�ⳣ����С����K1=K2
=4��a��b����¶���ͬ����K1=K2��c���¶ȵ���a��b�㣬�¶�����ƽ�����淴Ӧ�����ƶ�����ѧƽ�ⳣ����С����K1=K2![]() K3��
K3��

����Ŀ��������һ����Ҫ����ԭ�ϡ�
(1)�¹���ѧ�ҹ�����1902�꿪ʼ�о��ɵ���������ֱ�Ӻϳɰ���
��֪����![]() ��H=a kJ/mol
��H=a kJ/mol
��ÿ�ƻ�lmol�йػ�ѧ����Ҫ���������±���
H-H | N-H | N��N |
436kJ | 391kJ | 946k |
��a=_________________��
(2)��ͼΪ��ͬ�¶�(T)����ͬͶ�ϱ�[n(![]() )/n(
)/n(![]() )]ʱ��Ӧ�ﵽƽ��ʱ
)]ʱ��Ӧ�ﵽƽ��ʱ![]() ��ת���ʱ仯���ߡ�
��ת���ʱ仯���ߡ�

��![]() ��
��![]() ��
��![]() ��
��![]() �Ĵ�С��ϵΪ__________________��
�Ĵ�С��ϵΪ__________________��
�ڱ����¶Ⱥ�������䣬���Ͷ�ϱ�[n(![]() )/n(
)/n(![]() )]�������´ﵽƽ��ʱ������˵��һ����ȷ����_______(����ĸ���)��
)]�������´ﵽƽ��ʱ������˵��һ����ȷ����_______(����ĸ���)��
A.![]() ��Ũ������
��Ũ������
B.![]() ��ת��������
��ת��������
C.![]() �������������
�������������
D.![]() ��Ũ�ȼ�С
��Ũ�ȼ�С
���¶�Ϊ![]() ʱ����2L�ܱ������м���1.0mol
ʱ����2L�ܱ������м���1.0mol![]() ��1.0mol
��1.0mol![]() ����5min��Ӧ�ﵽƽ�⣬����v(
����5min��Ӧ�ﵽƽ�⣬����v(![]() )��ʾ�÷�Ӧ��ƽ������Ϊ____________________����Ӧ��
)��ʾ�÷�Ӧ��ƽ������Ϊ____________________����Ӧ��![]() ʱ��ƽ�ⳣ��K=________________��
ʱ��ƽ�ⳣ��K=________________��
(3)һ�����ͳ������е�������ķ����Dz���![]() ����ԭ����ԭ�����еĵ��������Ҳ�������Ⱦ��д��
����ԭ����ԭ�����еĵ��������Ҳ�������Ⱦ��д��![]() ��ԭ
��ԭ![]() �Ļ�ѧ��Ӧ����ʽ_____________________________________��
�Ļ�ѧ��Ӧ����ʽ_____________________________________��
(4)���ñ�����ⶨijϡ��ˮ��Ũ�ȣ�Ӧѡ��__________��ָʾ�����ζ��������۾�ע��_____________����֪ϡ��ˮ���Ϊ25.0mL���ζ������������0.0100mol/L�����ƽ�����Ϊ20.0mL����ð�ˮ��Ũ��Ϊ________________(����2λ��Ч����)�����ζ�ǰ�ζ��ܼ��������ݣ��ζ�����������ݣ���ⶨ���________(�ƫ����ƫС���������䡱)��
����Ŀ���ο�����ͼ�����й�Ҫ��ش����⣺
��1��ͼ����1molNO2(g)��1molCO(g)��Ӧ����CO2��NO�����������仯ʾ��ͼ�����ڷ�Ӧ��ϵ�м����������Ӧ��������E1�ı仯��___(��������������С����������������ͬ)����H�ı仯��__����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��__��

��2���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�
��CH3OH(g)��H2O(g)=CO2(g)��3H2(g) ��H����49.0kJ��mol��1
��CH3OH(g)��![]() O2(g)=CO2(g)��2H2(g) ��H����192.9kJ��mol��1
O2(g)=CO2(g)��2H2(g) ��H����192.9kJ��mol��1
��֪��H2O(g)=H2O(l) ��H����44kJ��mol��1
��״�ȼ������Һ̬ˮ���Ȼ�ѧ����ʽ��___��
��3���±��Dz��ֻ�ѧ���ļ������ݣ�
��ѧ�� | P��P | P��O | O=O | P=O |
����/kJ��mol��1 | a | b | c | x |
��֪1mol����(P4)��ȫȼ�շ���ΪdkJ����������ȫȼ�յIJ���ṹ��ͼ����ʾ�������x��___kJ��mol��1(�ú���a��b��c��d�Ĵ���ʽ��ʾ)��