题目内容
14.目前地球环境污染问题越来越严重,如温室效应、臭氧层破坏、光化学烟雾事件、酸雨的形成、有毒物质的污染等已成为世界各国普遍关注和研究的问题.请回答:(1)产生温室效应的原因主要是大气中含有大量的C(填序号,下同).
A.SO2 B.NO2 C.CO2 D.CO
(2)臭氧层的破坏导致紫外线对地球表面辐射的增加,从而使全球皮肤癌的发病率明显增加.造成这一现象的主要原因是A.
A.人们大量使用了氟氯烃
B.人们在炼钢时向空气中排放了大量高炉煤气
C.石油炼制厂排放了大量甲烷、氢气
D.硝酸、硫酸工厂排放了大量的二氧化碳和一氧化氮
(3)在上世纪60年代,一些工业发达国家的城市都相继发生过光化学烟雾事件,并造成数以千计的人员伤亡,光化学烟雾事件产生的主要原因是A.
A.汽油的不完全燃烧 B.大量使用了化肥和农药
C.白色塑料垃圾的漂浮D.金属矿物的冶炼
(4)为了减少大气中二氧化碳的含量,下列措施不可行的是ABD.
A.改进能源结构B.提高能源利用率
C.大量使用化石燃料 D.提倡植树种草.
分析 (1)依据造成温室效应的气体主要是二氧化碳,此外,还有甲烷、臭氧、氟利昂等解答;
(2)A.氟氯代烷能破坏臭氧层;
B.二氧化硫是形成酸雨的主要成分;
C.甲烷能产生温室效应;
D.二氧化硫、氮氧化物是形成酸雨的主要物质;
(3)光化学烟雾的形成主要是汽车尾气排放出的氮氧化物发生复杂的变化造成的;
(4)大气中CO2含量的增大,易使地球变暖,海平面上升,陆地面积减少,产生“温室效应”.为了减少大气中CO2的含量,改变能源结构,发展太阳能,水能等,提高能源利用率,提倡植树种草等少用化石燃料.
解答 解:(1)造成温室效应的气体主要是二氧化碳,此外,还有甲烷、臭氧、氟利昂等,
故选:C;
(2)氟氯代烃对臭氧层有很大的破坏作用,会使臭氧层形成空洞,从而使更多的紫外线照射到地球表面,导致皮肤癌的发病率大大增加,故A正确;B.高炉煤气中含有二氧化硫,二氧化硫是导致酸雨的主要成分,故B错误;C.产生温室效应的气体主要是二氧化碳,还有甲烷、臭氧、氟利昂等,故C错误;D.二氧化硫、氮氧化物是形成酸雨的主要物质,氮氧化物还是形成光化学烟雾的罪魁祸首,所以硫酸、硝酸工厂排放了大量的二氧化硫和一氧化氮导致形成酸雨,故D错误;
故选:A;
(3)A.汽油的不完全燃烧主要污染物为碳氢化合物、氮氧化合物、一氧化碳、二氧化硫、含铅化合物、苯丙芘及固体颗粒物等,能引起光化学烟雾,故A正确;
B.大量使用了化肥和农药严重污染水体、大气和土壤,造成环境污染,与光化学烟雾无关,故B错误;
C.白色塑料垃圾的漂浮,属于白色污染与光化学烟雾无关,故C错误;
D.金属矿物中含硫或硫的化合物,因此冶炼时,往往会生成二氧化硫,但与光化学烟雾无关,故D错误;
故答案为:A;
(4)A.改进能源结构,减少化石燃料的使用,能够减少大气中二氧化碳的含量,故A正确;
B.提高能源利用率,能节约能源且减少二氧化碳的排放,故B正确;
C.大量使用化石燃料,会增加二氧化碳的排放,故C错误;
D.CO2是光合作用的重要原料,提倡植树种草,会有效的利用二氧化碳,减少二氧化碳的含量,故D正确;
故选:ABD.
点评 本题考查了环境污染与治理,明确物质的性质是解本题关键,注意对温室效应、光化学烟雾、酸雨、臭氧层的破坏等知识的积累,题目难度不大.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 热化学方程式中化学计量数表示分子个数 | |
| B. | 该反应的△H2=+483.6kJ/mol | |
| C. | △H2<△H1 | |
| D. | △H1<△H2 |
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界无热量交换)密闭容器中进行该反应,化学平衡常数不变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO, 反应达到平衡前的速率:v(正)<v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| A. | 向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2═2I2+2H2O | |
| D. | 向硝酸铵溶液中滴加NaOH溶液:NH4++OH-═NH3↑+H2O |
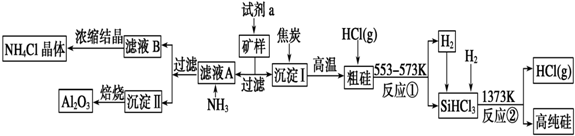
| A. | 纯硅 | B. | 玻璃 | C. | SiO2 | D. | 沙子 |
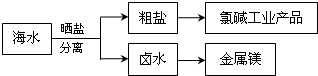
| A. | 通过氯碱工业可生产的产品仅仅为NaOH、Cl2 | |
| B. | 除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→适量盐酸 | |
| C. | 可将MgCl2•6H2O晶体在空气中直接加热脱水得到较纯净的无水MgCl2 | |
| D. | 电解MgCl2溶液可制取金属镁 |
| A. | AlCl3 溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| D. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
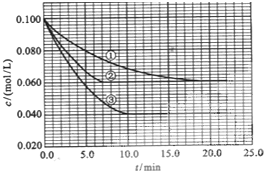 在溶液中,反应A+2B═C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100kJ•mol-1、c(B)=0.200kJ•mol-1及c(C)=0kJ•mol-1.反应物A的浓度随时间的变化如下图所示.
在溶液中,反应A+2B═C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100kJ•mol-1、c(B)=0.200kJ•mol-1及c(C)=0kJ•mol-1.反应物A的浓度随时间的变化如下图所示.