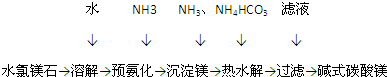
题目内容
4.(1)①NaOH溶液 ②铜 ③HCl ④CO2 ⑤酒精 ⑥熔融氯化钠 ⑦蔗糖属于电解质的是③⑥;属于非电解质的是④⑤⑦.
(2)等物质的量的H2和CO2原子个数比为2:3,质量比为1:22.
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
(2)等物质的量的H2和CO2所含分子数目相等,它们含有原子数目之比等于各分子含有原子总数之比;根据m=nM计算二者质量之比.
解答 解:①NaOH溶液为混合物,即不是电解质也不是非电解质;
②铜为金属单质,存在自由移动的电子,能导电,既不是电解质也不是非电解质;
③HCl在水溶液中或熔融状态下能够导电,是电解质;
④CO2的水溶液能导电,但不是它本身导电,是它与水反应生成的碳酸导电,属于非电解质;
⑤酒精在水溶液中或熔融状态下不能导电,是非电解质;
⑥熔融的氯化钠能导电,是电解质;
⑦蔗糖在水溶液中或熔融状态下不能导电,是非电解质;
(1)属于电解质的是③⑥;属于非电解质的是④⑤⑦;
故答案为:③⑥;④⑤⑦;
(2)等物质的量的H2和CO2所含分子数目相等,故含有含有原子总数之比为2:3;根据m=nM可知,等物质的量的CO和CO2质量之比为2g/mol:44g/mol=1:22,
故答案为:2:3;1:22.
点评 本题考查物质的电解质、非电解质概念的辨析以及物质的量有关计算,难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件.

练习册系列答案
相关题目
10. 茉莉香醇是一种具有甜香味的物质,是合成香料的重要原料,其结构简式如下:
茉莉香醇是一种具有甜香味的物质,是合成香料的重要原料,其结构简式如下:
下列有关茉莉香醇的叙述正确的是( )
 茉莉香醇是一种具有甜香味的物质,是合成香料的重要原料,其结构简式如下:
茉莉香醇是一种具有甜香味的物质,是合成香料的重要原料,其结构简式如下:下列有关茉莉香醇的叙述正确的是( )
| A. | 茉莉香醇的分子式为C9H14O2 | |
| B. | 不能使溴的四氯化碳溶液褪色 | |
| C. | 能与FeCl3溶液发生显色反应 | |
| D. | 能发生加成反应而不能发生取代反应 |
12.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,64gCu与足量浓硝酸反应恰好生成2NA个NO2分子 | |
| B. | 120gNaHSO4固体中含有NA个阳离子 | |
| C. | Si-O键的键能大于Si-Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
19.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图装置①.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列有关叙述不正确的是( )


| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 | |
| C. | 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
9.下列说法中正确的是( )
| A. | 硫酸的摩尔质量是98 | |
| B. | 摩尔是阿伏加德罗常数个微粒的集合体 | |
| C. | 6.02Х1023就是阿伏加德罗常数 | |
| D. | 氧气的摩尔质量(单位:g•mol-1)在数值上等于它的相对分子质量 |