题目内容
13.A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知A、C、F位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.试回答:(1)写出下列元素的元素符号:
ANa,BMg,CAl,DSi,EP,FCl.
(2)元素D的原子结构示意图为
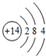 .
.(3)写出A与F形成的化合物的电子式
 .
.(4)A、C两种元素最高价氧化物的水化物之间反应的化学方程式为Al(OH)3+OH-═AlO2-+2H2O.C元素最高价氧化物的水化物与F元素氢化物的水溶液之间反应的离子方程式为Al(OH)3+3H+═Al3++3H2O.
(5)F元素在周期表中的位置是第三周期VIIA族,它的氢化物的化学式为HCl,该氢化物的稳定性比D的氢化物稳定性强(“强”或“弱”)
分析 A、B、C、D、E、F六种短周期元素的原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E原子有3个电子层,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素的原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E原子有3个电子层,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg.
(1)由上述分析可知,A为Na,B为Mg,C为Al,D为Si,E为P,F为Cl,
故答案为:Na;Mg;Al;Si;P;Cl;
(2)D为Si,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)A、F形成的化合物为NaCl,用电子式表示其形成过程为 ,
,
故答案为: ;
;
(3)A、C两种元素最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,F元素氢化物为HCl,氢氧化铝与盐酸反应离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;Al(OH)3+3H+═Al3++3H2O;
(4)F为Cl元素,在周期表中位置为:第三周期VIIA族,其氢化物为HCl,由于非金属性Cl>Si,故HCl的稳定性较强,
故答案为:第三周期VIIA族;HCl;强.
点评 本题考查结构性质位置关系应用,难度不大,注意基础知识的理解掌握,推断元素是解题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案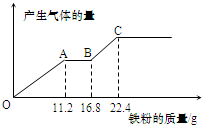 取某稀硫酸和稀硝酸的混合溶液100mL.向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸被还原为NO气体).下列分析或结果正确的是( )
取某稀硫酸和稀硝酸的混合溶液100mL.向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸被还原为NO气体).下列分析或结果正确的是( )| A. | 最终溶液中所含的溶质为FeSO4 | |
| B. | OA段产生的气体是H2,BC段产生的气体是NO | |
| C. | 整个反应中转移电子数为1.2mol | |
| D. | 混合酸中NO3-的物质的量为0.2 mol |
| A. | PH4I可由PH3和HI化合而得 | |
| B. | PH4I在物质分类中属于正盐 | |
| C. | PH4I对热不稳定,受热时产生有色气体 | |
| D. | PH4I属于共价化合物 |
| A. | ④①③① | B. | ④①③③ | C. | ④③④③ | D. | ①②④③ |
| A. | 该NaCl溶液显酸性 | |
| B. | 该NaCl溶液显中性 | |
| C. | 该NaCl溶液中KW=1×10-14 mol2•L-2 | |
| D. | 该NaCl溶液中KW=1×10-12 mol2•L-2 |
| A. | H+、Na+、SiO${\;}_{3}^{2}$、NO${\;}_{3}^{-}$ | B. | Ag+、Fe3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | ||
| C. | H+、Cu2+、Cl-、NO3- | D. | NH${\;}_{4}^{+}$、H+、SO${\;}_{4}^{2-}$、HCO3- |
 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 能使溴水褪色,且静置后分层 | B. | 不能发生取代反应 | ||
| C. | 能使高锰酸钾溶液褪色 | D. | 可以燃烧 |
| A. | 氯气、二氧化氯、臭氧都可用于自来水的消毒 | |
| B. | 氯水、漂白液、漂白粉的溶液都能是有色布条褪色 | |
| C. | 某溶液加入硝酸银溶液产生白色沉淀,加入盐酸沉淀不消失,该溶液一定含Cl- | |
| D. | 氯气在化学工业中可用来制取高纯度的硅、锗、钛 |
 实验室中按照一定顺序混合2mL浓硫酸、3mL乙醇、2mL乙酸后加热制备乙酸乙酯,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上(如图所示).
实验室中按照一定顺序混合2mL浓硫酸、3mL乙醇、2mL乙酸后加热制备乙酸乙酯,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上(如图所示).