题目内容
【题目】CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJmol-1和-726.5kJmol-1;CH3OH(1)=CH3OH (g) △H=+35.2kJmol-1;H2O(1)=H2O(g) △H=+44kJmol-1。
则CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=___kJmol-1。有利于提高H2平衡转化率的条件是___(填选项字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___ (保留两位小数)。
③起始条件(T1℃、2L密闭容器)如表所示:
CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
I(恒温恒容) | 2 | 6 | 0 | 0 |
II(绝热恒容) | 0 | 0 | 2 | 2 |
达到平衡时,该反应的平衡常数:K(I)___K(Ⅱ)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度:c(I)___c(Ⅱ)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)CH2=CH2(g)+4H2O(g) △H=-127.8 kJmol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的体积分数(φ)如图所示:
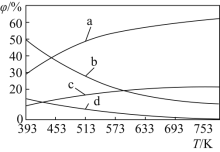
①曲线b、c表示的物质分别为___、___(填化学式)。
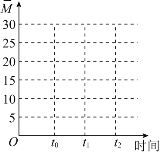
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化趋势图象___。
【答案】-51.7 B 0.05 < < H2O CO2 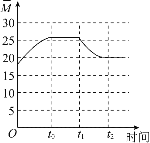
【解析】
(1)①依据盖斯定律进行分析;
②依据平衡常数的表达式计算;
③依据升高温度平衡向吸热方向移动,降低温度平衡向放热方向移动,根据移动方向判断平衡常数的大小;
(2)依据参与反应的物质的量之比等于化学计量数之比进行分析;
![]() 反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)可由表示氢气燃烧热的热化学方程式的3倍减去表示甲醇燃烧热的热化学方程式再加上CH3OH(1)=CH3OH (g) △H=+35.2kJmol-1;H2O(1)=H2O(g) 得到,根据盖斯定律,其反应热应等于
反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)可由表示氢气燃烧热的热化学方程式的3倍减去表示甲醇燃烧热的热化学方程式再加上CH3OH(1)=CH3OH (g) △H=+35.2kJmol-1;H2O(1)=H2O(g) 得到,根据盖斯定律,其反应热应等于
-285.8kJmol-1×3-(-726.5kJmol-1)+ 35.2kJmol-1+44kJmol-1 =-51.7kJmol-1;
因此该反应的正反应是放热反应,低温有利于提高![]() 平衡转化率,该反应的正反应是气体减少的反应,高压有利于提高
平衡转化率,该反应的正反应是气体减少的反应,高压有利于提高![]() 平衡转化率;
平衡转化率;
故答案为:![]() ;B;
;B;
![]() 平衡时
平衡时![]() 的转化率为
的转化率为![]() ,即氢气减少了3mol,则二氧化碳减少了1mol,生成甲醇和水各1mol,因此平衡时
,即氢气减少了3mol,则二氧化碳减少了1mol,生成甲醇和水各1mol,因此平衡时![]() 、
、![]() 、
、![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() 、
、![]() 、
、![]() ,平衡常数为
,平衡常数为![]() ;
;
故答案为:![]() ;
;
![]() 正反应放热,逆反应吸热,因容器Ⅱ是从逆反应开始的,因此绝热容器中的温度会降低,而放热反应的平衡常数随温度降低是增大的,因此
正反应放热,逆反应吸热,因容器Ⅱ是从逆反应开始的,因此绝热容器中的温度会降低,而放热反应的平衡常数随温度降低是增大的,因此![]() Ⅱ
Ⅱ![]() ;
;
如果温度相同体积相同,两个容器的平衡状态是完全一样的,但平衡容器Ⅱ的温度低,降低温度,平衡会向右移动,因此平衡时![]() 的浓度:
的浓度:![]() Ⅱ
Ⅱ![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() 正反应是放热反应,升高温度,平衡逆向移动,因此减少的是乙烯和水,但水的减少量要大于乙烯,因此b是水,d是乙烯;平衡逆向移动,增加的是二氧化碳和氢气,氢气的变化量要大于二氧化碳,因此a是氢气,c是二氧化碳;故答案为:
正反应是放热反应,升高温度,平衡逆向移动,因此减少的是乙烯和水,但水的减少量要大于乙烯,因此b是水,d是乙烯;平衡逆向移动,增加的是二氧化碳和氢气,氢气的变化量要大于二氧化碳,因此a是氢气,c是二氧化碳;故答案为:![]() ;
;![]() ;
;
![]() 气体的总质量不变,因此平均相对分子质量和气体的总的物质的量呈反比,起始到
气体的总质量不变,因此平均相对分子质量和气体的总的物质的量呈反比,起始到![]() 时刻,反应向右,气体的物质的量减小,则平均相对分子质量增大,
时刻,反应向右,气体的物质的量减小,则平均相对分子质量增大,![]() 时刻到
时刻到![]() 时刻,处于平衡状态,混合气体的平均相对分子质量不变,
时刻,处于平衡状态,混合气体的平均相对分子质量不变,![]() 时将容器体积瞬间扩大至2VL并保持不变,
时将容器体积瞬间扩大至2VL并保持不变,![]() 时重新达到平衡,压强减小,平衡逆向移动,气体的物质的量增大,则平均相对分子质量减小,
时重新达到平衡,压强减小,平衡逆向移动,气体的物质的量增大,则平均相对分子质量减小,![]() 时刻之后,处于平衡状态,混合气体的平均相对分子质量不变,因此容器内混合气体的平均相对分子质量M随时间的变化图象为
时刻之后,处于平衡状态,混合气体的平均相对分子质量不变,因此容器内混合气体的平均相对分子质量M随时间的变化图象为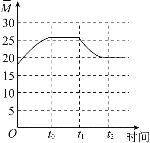 ;故答案为:
;故答案为: 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3H2O吸收。已知2NH3H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O(l) ΔH=-24.2kJ/mol,中和热ΔH=-57.3kJ/mol则1molNH3H2O理论上完全电离时需要吸收的热量为___。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为47之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式___。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4molSO2,发生SO2(g)+NO2(g)SO3(g)+NO(g) ΔH=-41.8kJ/mol在不同温度下测定同一时刻NO2的转化率,结果如图所示。
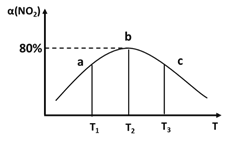
①a、c两点反应速率大小关系:v正(a)___v逆(c)。(填“>”“<”或“=”)
②温度为T2时,该反应的平衡常数为___。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率___(填“增大”“减小”或“不变”)。
【题目】将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得,![]() 浓度越大,镁和水反应速率越快
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,![]() 都能加快镁和水的反应
都能加快镁和水的反应