题目内容
【题目】工业电解饱和食盐水产生的氯气制漂白粉,所进行的反应是
① 2NaCl+2H2O![]() Cl2+H2+2NaOH
Cl2+H2+2NaOH
② 2Ca(OH)2(石灰乳)+ 2Cl2 =CaCl2+Ca(ClO)2+2H2O
某厂日产漂白粉(含量80%,主要杂质Ca(OH)2)20吨,已知进行①步反应的转化率90%,进行②步转化率85%。
(1)写出②反应的离子方程式并用双线桥标出电子转移数目
(2)列式计算该厂日消耗精制后的NaCl多少摩尔?(科学计数值,保留小数点后两位)
【答案】
(1)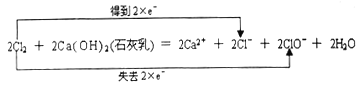
(2)3.29×105mol
【解析】
试题分析:(1)反应②中Cl元素化合价部分升高,部分降低,转移2个电子,用双线桥标出电子转移数目为: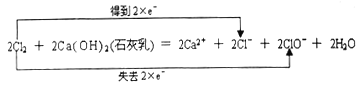 ;
;
(2)设消耗精制后的NaCl的物质的量为x,
根据①2NaCl+2H2O![]() Cl2+H2+2NaOH
Cl2+H2+2NaOH
②2Ca(OH)2(石灰乳)+2Cl2=CaCl2+Ca(ClO)2+2H2O
有4NaCl~~~2Cl2~~~~CaCl2+Ca(ClO)2
4mol 254g
x×90%×85% 20×106g×80%
![]() =
=![]() ,解得x=3.29×105mol,故答案为:3.29×105mol。
,解得x=3.29×105mol,故答案为:3.29×105mol。

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目