题目内容
取500mL Na2CO3溶液与300mL 1mol?L-1盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3:2.则碳酸钠溶液的物质的量浓度为
- A.0.4 mol?L-1
- B.0.3 mol?L-1
- C.0.2 mol?L-1
- D.0.5 mol?L-1
A
分析:将碳酸钠溶液逐滴滴入盐酸中,盐酸过量,发生反应是Na2CO3+2HCl=2NaCl+CO2↑+H2O,将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生的反应是Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O.
如果对两个过程,盐酸都过量,则两次产生CO2应该一样多,但两者不同,说明在第一个过程中盐酸完全反应,碳酸钠有剩余,第二过程中盐酸也完全反应,但有碳酸氢钠剩余.
根据HCl的物质的量计算第一个过程的二氧化碳的物质的量,进而计算第二个过程生成二氧化碳的物质的量,根据方程式:NaHCO3+HCl=NaCl+CO2+H2O计算参加该反应的HCl的物质的量,进而计算反应:Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl的物质的量,据此计算Na2CO3的物质的量,再根据c= 计算.
计算.
解答:将碳酸钠溶液逐滴滴入盐酸中,盐酸过量,发生反应是Na2CO3+2HCl=2NaCl+CO2↑+H2O,将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生的反应是Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O.如果对两个过程,盐酸都过量,则两次产生CO2应该一样多,但两者不同,说明在第一个过程中盐酸完全反应,碳酸钠有剩余,第二过程中盐酸也完全反应,但有碳酸氢钠剩余,
n(HCl)=0.3L×1mol/L=0.3mol,故第一个过程生成二氧化碳为0.3mol× =0.15mol,则第二个过程生成二氧化碳为0.15mol×
=0.15mol,则第二个过程生成二氧化碳为0.15mol× =0.1mol,故反应NaHCO3+HCl=NaCl+CO2+H2O中消耗的HCl为0.1mol,反应Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl为0.3mol-0.1mol=0.2mol,故碳酸钠的物质的量为0.2mol,物质的量浓度为
=0.1mol,故反应NaHCO3+HCl=NaCl+CO2+H2O中消耗的HCl为0.1mol,反应Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl为0.3mol-0.1mol=0.2mol,故碳酸钠的物质的量为0.2mol,物质的量浓度为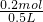 =0.4mol/L,故选A.
=0.4mol/L,故选A.
点评:本题考查方程式的有关计算,清楚滴加顺序不同发生的反应,判断向盐酸中滴加碳酸钠盐酸完全反应是关键.
分析:将碳酸钠溶液逐滴滴入盐酸中,盐酸过量,发生反应是Na2CO3+2HCl=2NaCl+CO2↑+H2O,将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生的反应是Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O.
如果对两个过程,盐酸都过量,则两次产生CO2应该一样多,但两者不同,说明在第一个过程中盐酸完全反应,碳酸钠有剩余,第二过程中盐酸也完全反应,但有碳酸氢钠剩余.
根据HCl的物质的量计算第一个过程的二氧化碳的物质的量,进而计算第二个过程生成二氧化碳的物质的量,根据方程式:NaHCO3+HCl=NaCl+CO2+H2O计算参加该反应的HCl的物质的量,进而计算反应:Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl的物质的量,据此计算Na2CO3的物质的量,再根据c=
 计算.
计算.解答:将碳酸钠溶液逐滴滴入盐酸中,盐酸过量,发生反应是Na2CO3+2HCl=2NaCl+CO2↑+H2O,将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生的反应是Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O.如果对两个过程,盐酸都过量,则两次产生CO2应该一样多,但两者不同,说明在第一个过程中盐酸完全反应,碳酸钠有剩余,第二过程中盐酸也完全反应,但有碳酸氢钠剩余,
n(HCl)=0.3L×1mol/L=0.3mol,故第一个过程生成二氧化碳为0.3mol×
 =0.15mol,则第二个过程生成二氧化碳为0.15mol×
=0.15mol,则第二个过程生成二氧化碳为0.15mol× =0.1mol,故反应NaHCO3+HCl=NaCl+CO2+H2O中消耗的HCl为0.1mol,反应Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl为0.3mol-0.1mol=0.2mol,故碳酸钠的物质的量为0.2mol,物质的量浓度为
=0.1mol,故反应NaHCO3+HCl=NaCl+CO2+H2O中消耗的HCl为0.1mol,反应Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl为0.3mol-0.1mol=0.2mol,故碳酸钠的物质的量为0.2mol,物质的量浓度为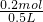 =0.4mol/L,故选A.
=0.4mol/L,故选A.点评:本题考查方程式的有关计算,清楚滴加顺序不同发生的反应,判断向盐酸中滴加碳酸钠盐酸完全反应是关键.

练习册系列答案
相关题目
取500mL Na2CO3溶液与300mL 1mol?L-1盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3:2.则碳酸钠溶液的物质的量浓度为( )
| A、0.4 mol?L-1 | B、0.3 mol?L-1 | C、0.2 mol?L-1 | D、0.5 mol?L-1 |
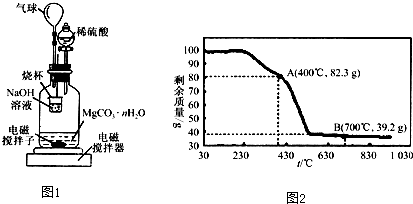
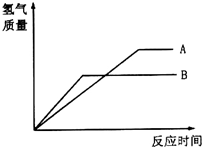 等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: