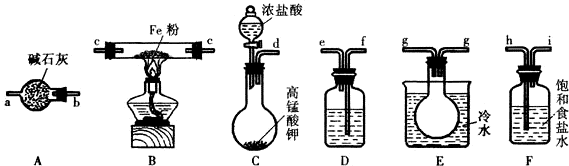
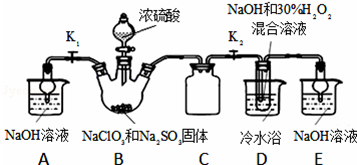
题目内容
18.某物质A加热时按下式分解:2A═2B+C+3D(产物均为气体),现测得由生成物组成的混合物气体对H2的相对密度为23,则反应物A的摩尔质量为138g/mol.分析 令A的物质的量为2mol,由方程式可知混合气体总物质的量为6mol,根据混合气体相对氢气密度计算混合气体的平均摩尔质量,根据m=nM计算混合气体总质量,由质量守恒定律可知A的质量等于混合气体总质量,再根据M=$\frac{m}{n}$计算A的摩尔质量.
解答 解:令A的物质的量为2mol,由方程式2A=2B+C+3D,可知混合气体总物质的量为2mol+1mol+3mol=6mol,
混合气体对氢气的相对密度为23,则混合气体平均摩尔质量=2g/mol×23=46g/mol,混合气体总质量=6mol×46g/mol,
由质量守恒定律可知A的质量等于混合气体总质量,故A的摩尔质量=$\frac{6mol×46g/mol}{2mol}$=138g/mol,
故答案为:138.
点评 本题考查物质的量计算、化学方程式计算,难度不大,关键是理解相同条件下气体的摩尔质量和气体的密度成正比

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
19.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①检查气体发生装置A的气密性的操作是关闭活塞a,打开止水夹b,将长导管末端浸入水中,用手捂住圆底烧瓶,导管口有气泡;松开手后,有水进入导管,则气密性良好;或方法二:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好..
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2.
ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应.ⅲ.AgClO、AgBrO均可溶于水.
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-?Fe(SCN)3平衡逆向移动而褪色,请设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理.或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为BrCl+2KI=KCl+KBr+I2.
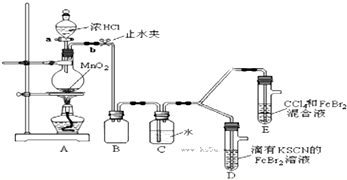
(1)①检查气体发生装置A的气密性的操作是关闭活塞a,打开止水夹b,将长导管末端浸入水中,用手捂住圆底烧瓶,导管口有气泡;松开手后,有水进入导管,则气密性良好;或方法二:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好..
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2.
ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应.ⅲ.AgClO、AgBrO均可溶于水.
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-?Fe(SCN)3平衡逆向移动而褪色,请设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理.或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为BrCl+2KI=KCl+KBr+I2.

9. 某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
(1)稀硫酸应放在1中(填写仪器编号).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B、打开开关AC就可观察到氢氧化亚铁的颜色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是铁粉进入导管从而堵塞导管.此空删去
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
滴定过程中发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色.
通过实验数据计算的该产品纯度为$\frac{980c}{a}$×100%(用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
 某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.(1)稀硫酸应放在1中(填写仪器编号).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B、打开开关AC就可观察到氢氧化亚铁的颜色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是铁粉进入导管从而堵塞导管.此空删去
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色.
通过实验数据计算的该产品纯度为$\frac{980c}{a}$×100%(用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
3.下列关于能量变化的叙述中不正确的是( )
| A. | 碳酸的电离为吸热过程,所以碳酸盐与盐酸反应放热 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则含 40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量多于57.3 kJ | |
| C. | 通过NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,可知 1molH2O(l)完全电离需要吸热57.3kJ | |
| D. | 铝热反应为放热反应 |
7.已知反应3H2(g)+N2(g)?2NH3(g)△H﹦-92.4KJ•mo1-1.某温度下,在带有活塞的密闭容器中充入一定量的NH3,充分反应后达到平衡.下列说法中正确的是( )
| A. | 保持体积不变,降温,平衡右移,逆反应速率增大 | |
| B. | 保持体积、温度不变,充入氦气后,正反应速率将增大 | |
| C. | 保持体积、温度不变,充入NH3气体,平衡向右移动 | |
| D. | 保持温度、压强不变,充入NH3气体,平衡混合气中NH3的体积分数不变 |
8.下列有关气体体积的叙述中,正确的是( )
| A. | 一定温度和压强下,气体体积的大小,由构成气体的分子大小决定 | |
| B. | 一定温度和压强下,气体体积的大小,由构成气体的分子数决定 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 气体摩尔体积指1mol任何气体所占的体积约为22.4L |