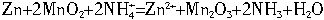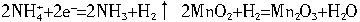题目内容
锌锰干电池是普遍使用的化学电源,其中含有MnO2、NH4Cl、ZnCl2等的糊状物,以锌筒为负极材料,石墨为正极材料。一节干电池,电动势E=1.5 V,内电阻r=0.25 Ω,对外供电时效率η=75%。该干电池的工作原理是:Zn+2MnO2+2![]()
![]() Zn2++Mn2O3+2NH3+2H2O
Zn2++Mn2O3+2NH3+2H2O
(1)写出该干电池放电时的电极反应式:
正极:_________________,负极:___________________。
(2)正极反应中,前后经历了下列两个反应:
2![]() +2e-
+2e-![]() 2NH3+H2↑,2MnO2+H2
2NH3+H2↑,2MnO2+H2![]() Mn2O3+H2O
Mn2O3+H2O
如果正极反应没有MnO2的参与,干电池将难以持续稳定的工作。试说明理由:____________。
(3)在通电10 min的时间内参加反应MnO2的质量约为多少?外电阻消耗的电能是多少?
___________________________________________________________
(4)许多国家对废旧电池进行回收,从保护环境和节约材料的方面解释为什么要回收废旧电池。
___________________________________________________________
(1)2MnO2+2![]() +2e-
+2e-![]() Mn2O3+2NH3+H2O Zn-2e-
Mn2O3+2NH3+H2O Zn-2e-![]() Zn2+
Zn2+
(2)正极反应中间产物H2附着于石墨棒上,增加电池内阻
(3)0.813 g 1012.5 J
(4)可以回收到大量的金属材料和化工原料。废旧电池有害于生态环境的物质在自然条件下极难被降解;废旧锌锰干电池含有高浓度的氯化铵溶液,埋在土壤中会使土壤酸化,种子脱水死亡。

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
 ,对外供电时的效率为?浊=75%。干电池的工作原理是:
,对外供电时的效率为?浊=75%。干电池的工作原理是: