题目内容
A、B、D、E为原子序数依次增大的短周期元素。A、B组成的气体甲能使湿润的红色石蕊试纸变蓝;A、D处于同一主族,E的最外层电子数等于其电子层数。
(1)B在元素周期表的位置是 ;四种元素的简单离子,半径最大的是 (填离子符号);单质D暴露于空气中最终产物是 。
(2)B的一种氧化物BO2与水反应的化学方程式为: 。
(3)甲和B的最高价氧化物的水化物反应生成乙。在0.1 mol·L-1乙溶液中,所含离子浓度由大到小的顺序是 。
(4)25℃时,E的最高价氧化物的水化物KSP=1.0×10-34,使含0.1 mol·L-1E离子的溶液开始产生沉淀的pH为 。
(1)B在元素周期表的位置是 ;四种元素的简单离子,半径最大的是 (填离子符号);单质D暴露于空气中最终产物是 。
(2)B的一种氧化物BO2与水反应的化学方程式为: 。
(3)甲和B的最高价氧化物的水化物反应生成乙。在0.1 mol·L-1乙溶液中,所含离子浓度由大到小的顺序是 。
(4)25℃时,E的最高价氧化物的水化物KSP=1.0×10-34,使含0.1 mol·L-1E离子的溶液开始产生沉淀的pH为 。
(1)第二周期VA族(1分 );N3-(2分 ); Na2CO3(2分 )
(2)3NO2 + H2O ="=" 2HNO3 + NO(2分 )
(3)c(NO3-)>c(NH4+)>c(H+)>c(OH-)(2分 ) (4)3(2分 )
(2)3NO2 + H2O ="=" 2HNO3 + NO(2分 )
(3)c(NO3-)>c(NH4+)>c(H+)>c(OH-)(2分 ) (4)3(2分 )
试题分析:A、B、D、E为原子序数依次增大的短周期元素。A、B组成的气体甲能使湿润的红色石蕊试纸变蓝,该气体是氨气,则A是氢元素,B是氮元素;A、D处于同一主族,且D的原子序数大于氮元素,所以D是钠元素;E的最外层电子数等于其电子层数,E是第三周期元素,所以E是铝元素。
(1)氮元素在元素周期表的位置是第二周期VA族;离子的电子层数越大,离子半径越大,在核外电子排布相同的条件下,原子序数越大,离子半径越小,因此四种元素的简单离子,半径最大的是N3-;钠是活泼的金属,极易与水、氧气反应,生成的氢氧化钠吸收二氧化碳变为碳酸钠,所以金属钠暴露于空气中最终产物是Na2CO3。
(2)氮元素的一种氧化物NO2与水反应的化学方程式为3NO2 + H2O=2HNO3 + NO。
(3)甲和B的最高价氧化物的水化物反应生成乙,则乙应该是硝酸铵。溶液中NH4+水解溶液显酸性,因此在0.1 mol·L-1乙溶液中,所含离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
(4)根据氢氧化铝的溶度积常数表达式KSP= c(Al3+)·c3(OH-)可知,要使含0.1 mol·L-1铝离子的溶液开始产生沉淀,则溶液的c(OH-)最小值为
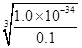 =1×10-11mol/L,则氢离子浓度是1×10-3mol/L,所以pH=3。
=1×10-11mol/L,则氢离子浓度是1×10-3mol/L,所以pH=3。
练习册系列答案
相关题目

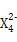 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
