题目内容
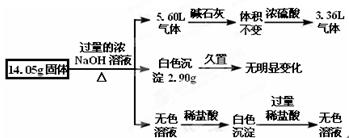
某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):下列说法中不正确的是( )

| A.该固体中一定没有FeCl2,可能含有AlCl3 |
| B.该固体中含有2.70 g Al |
| C.该固体中含有6.60 g (NH4)2SO4 |
| D.该固体中含有4.75 g MgCl2 |
A
试题分析:往混合固体中加入过量浓的NaOH溶液,能够生成气体的有Al、(NH4)2SO4 ,气体分别是H2和NH3,把气体通过碱石灰干燥,气体体积不变,再通过浓硫酸,气体体积减小且不为零,所以可知生成的气体为H2和NH3 ,体积分别为3.36L和2.3L,原固体混合物中一定有Al、(NH4)2SO4 ,由体积可以分别计算得m(Al)=2.70g、m[(NH4)2SO4]=6.60g;又碱过量有白色沉淀生成,且白色沉淀久置不变色,则一定没有FeCl2,沉淀为Mg(OH)2是2.9g,由此可计算得m(MgCl2)=4.75g;由此m(Al)+m[(NH4)2SO4] +m(MgCl2)= 2.70g +6.60g +4.75g=14.05g,所以固体混合物中只有这三种物质,一定没有AlCl3 ,所以A错误,故选A。

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目