题目内容
【题目】现有48.4 g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150 mL某浓度的盐酸中,充分反应后生成CO2 4.48 L(已折算成标准状况下),所得溶液稀释至250 mL,测得溶液的c(H+)=0.100 mol·L-1。

按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=________mol·L-1。
(2)x∶y∶z=________。
【答案】 3.50 )4∶1∶5
【解析】(1)24.2g样品与盐酸反应放出的二氧化碳的物质的量为![]() =0.2mol,即n(MgCO3)=0.2mol,将24.2g样品灼烧至恒重得到10.0g氧化镁,含有镁元素的物质的量为
=0.2mol,即n(MgCO3)=0.2mol,将24.2g样品灼烧至恒重得到10.0g氧化镁,含有镁元素的物质的量为![]() =0.25mol,则n[Mg(OH)2]=0.25mol-0.2mol=0.05mol,反应的盐酸的物质的量为0.2mol×2+0.05mol×2=0.5mol,溶液中剩余的氢离子的物质的量为0.100 mol·L-1×0.25L=0.025mol,因此盐酸中氯化氢的总量为0.5mol+0.025mol=0.525mol,则c(HCl)=
=0.25mol,则n[Mg(OH)2]=0.25mol-0.2mol=0.05mol,反应的盐酸的物质的量为0.2mol×2+0.05mol×2=0.5mol,溶液中剩余的氢离子的物质的量为0.100 mol·L-1×0.25L=0.025mol,因此盐酸中氯化氢的总量为0.5mol+0.025mol=0.525mol,则c(HCl)=![]() =3.50mol/L,故答案为:3.50;
=3.50mol/L,故答案为:3.50;
(2)根据题意,24.2g样品与盐酸反应放出的二氧化碳的物质的量为![]() =0.2mol,即n(MgCO3)=0.2mol,将24.2g样品灼烧至恒重得到10.0g氧化镁,含有镁元素的物质的量为
=0.2mol,即n(MgCO3)=0.2mol,将24.2g样品灼烧至恒重得到10.0g氧化镁,含有镁元素的物质的量为![]() =0.25mol,则n[Mg(OH)2]=0.25mol-0.2mol=0.05mol,含有结晶水的质量为24.2g-0.2mol×84g/mol-0.05mol×58g/mol=4.5g,物质的量为
=0.25mol,则n[Mg(OH)2]=0.25mol-0.2mol=0.05mol,含有结晶水的质量为24.2g-0.2mol×84g/mol-0.05mol×58g/mol=4.5g,物质的量为![]() =0.25mol,x∶y∶z=0.2mol:0.05mol:0.25mol=4∶1∶5。
=0.25mol,x∶y∶z=0.2mol:0.05mol:0.25mol=4∶1∶5。

【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯.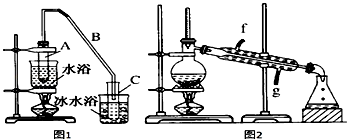
已知: ![]()
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填“上”或“下”),分液后用(填选项字母)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从进入.蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(填选项字母).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是(填选项字母).a.用酸性高锰酸钾溶液 b.用金属钠 c.用溴水 d.测定沸点.
【题目】某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K= ![]() .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【题目】根据所学知识完成题目:
(1)(Ⅰ)已知在448℃时,反应H2(g)+I2(g)2HI(g)的平衡常数 K1为49,则该温度下反应2HI(g)H2(g)+I2(g)的平衡常数K2为![]() ;反应
;反应 ![]() H2(g)+
H2(g)+ ![]() I2(g)HI(g)的平衡常数K3为 .
I2(g)HI(g)的平衡常数K3为 .
(2)(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K= .
②该反应为反应(填“吸热”或“放热”).
③能判断该反应达到化学平衡状态的依据是 .
A.容器中压强不变 B.混合气体中c(CO)不变 C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为1.5mol/L,c(CO)为1mol/L,c(H2O)为3mol/L,则下一时刻,反应向(填“正向”或“逆向”)进行.

