题目内容
下列各实验装置图的叙述中,正确的是( )


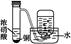
| A.装置①为放出萃取溴水后的苯层 |
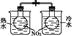
| B.装置②为喷泉实验 |
| C.装置③可用来吸收HCl气体 |
| D.以NH4Cl为原料,装置④可用于制备少量NH3 |
B
苯的密度比水小,在水的上层,分液漏斗内的液体下层从分液漏斗活塞处放出,上层液体应从分液漏斗上口倒出,A项错误;CO2与NaOH溶液反应,装置②可以形成喷泉,B项正确;装置③中HCl气体与水直接接触,不能防止倒吸,C项错误;氯化铵受热分解为氨气和氯化氢,但氨气和氯化氢在试管口处遇冷又会化合生成氯化铵,D项错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 NH4NO2+NaCl
NH4NO2+NaCl