题目内容
2.下列叙述不正确的是( )| A. | 配制0.1 mol•L-1的Na2SO3溶液490mL,需用500ml容量瓶 | |
| B. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) | |
| C. | 在标准状况下,将22.4L氨气溶于1L水中,得到1mol•L-1的氨水 | |
| D. | 10mL质量分数为70%的乙醇用10mL水稀释后;乙醇的质量分数小于35% |
分析 A、没有490ml容量瓶,应选择500ml容量瓶进行配制;
B、发生反应:2Na2O2+2H2O═4NaOH+O2↑,Na2O+H2O═2NaOH,由方程式可知,相同物质的量的Na2O2和Na2O的消耗相同物质的量的水,生成相同物质的量的NaOH,保持温度不变,使溶液恰好饱和,故加入的Na2O2、Na2O的物质的量相等;
C、根据c=$\frac{n}{V}$,体积V指的是溶液的体积,而不是溶剂水的体积;
D.乙醇的密度小于水,加水等体积稀释,稀释后的质量分数比原来的一半要小.
解答 解:A、需用490mL0.1 mol•L-1的Na2SO3溶液,没有490ml容量瓶,应选择500ml容量瓶进行配制,故A正确;
B、若要生成80份质量的氢氧化钠,需要78份质量的过氧化钠,同时消耗18份质量的水,需要62份质量的氧化钠,同时消耗18份质量的水,则加入的Na2O2与Na2O的物质的量之比等于1:1,故B正确;
C、在标准状况下,22.4L氨气的物质的量为1mol,配成1L溶液而不是溶于1L水中,得到1mol/L的氨水,故C错误;
D、10mL质量分数为70%的乙醇用10mL水稀释后;乙醇的质量分数小于原来的一半,故D正确,
故选C.
点评 本题考查溶液浓度计算、基本操作,注意理解掌握物质的量浓度与质量分数之间的关系.注意实验室常用容量瓶的规格,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列关于纯水的说法不正确的是( )
| A. | 纯水具有较弱的导电性 | B. | 水分子在任何条件下都能发生电离 | ||
| C. | 常温下水能发生电离 | D. | 水的电离是一个可逆反应 |
13.我国农业因酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规.
(1)现有雨水样品1份,每隔一段时间测定数据如下:
根据上述材料回答下列问题:(已知Cl2+SO2+2H2O═H2SO4+2HCl)
①酸雨放置时,pH发生变化的主要原因是(用化学方程式表示)2H2SO3+O2=2H2SO4.
②如果将刚取样的上述雨水与少量新鲜自来水混合,pH将变小(填“变大”、“变小”或“不变”).
(2)你认为以下哪些做法是减少酸雨产生的途径①③⑤
①少用煤作燃料 ②把烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
(3)下列物质不属于“城市空气质量日报”报道的是C
A.二氧化硫B.氮氧化物C.二氧化碳D.可吸入颗粒物.
(1)现有雨水样品1份,每隔一段时间测定数据如下:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 |
①酸雨放置时,pH发生变化的主要原因是(用化学方程式表示)2H2SO3+O2=2H2SO4.
②如果将刚取样的上述雨水与少量新鲜自来水混合,pH将变小(填“变大”、“变小”或“不变”).
(2)你认为以下哪些做法是减少酸雨产生的途径①③⑤
①少用煤作燃料 ②把烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
(3)下列物质不属于“城市空气质量日报”报道的是C
A.二氧化硫B.氮氧化物C.二氧化碳D.可吸入颗粒物.
17.在水中加入下列物质,可使水的电离平衡正向移动的是( )
| A. | Na2CO3 | B. | BaCl2 | C. | NaCl | D. | H2SO4 |
7.下列叙述中不正确的是( )
| A. | 从柑桔中可提炼出苧烯( ),其分子式为C10H16,是1,3丁二烯的同系物 ),其分子式为C10H16,是1,3丁二烯的同系物 | |
| B. | 化学式为C4H10O的醇可被氧化成醛的有2种 | |
| C. | 2-氯丁烷( )与NaOH乙醇溶液共热发生消去反应的产物有2种 )与NaOH乙醇溶液共热发生消去反应的产物有2种 | |
| D. | 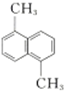 与 与 的一氯代物的数目不相等 的一氯代物的数目不相等 |
11.(1)已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO${\;}_{3}^{-}$→I2 MnO${\;}_{4}^{-}$→Mn2+ HNO2→NO
如果分别用1mol这些物质氧化足量的KI,得到I2的物质的量分为:
(2)铁和某浓度的硝酸反应时,消耗铁和硝酸的物质的量之比为8:25,且铁转化为等物质的量的Fe2+和Fe3+,则硝酸的唯一还原产物可能为NH4NO3.
H2O2→H2O IO${\;}_{3}^{-}$→I2 MnO${\;}_{4}^{-}$→Mn2+ HNO2→NO
如果分别用1mol这些物质氧化足量的KI,得到I2的物质的量分为:
| 氧化剂 | I2的物质的量(mol) | 氧化剂 | I2的物质的量(mol) |
| H2O2 | IO3- | ||
| MnO4- | HNO2 |
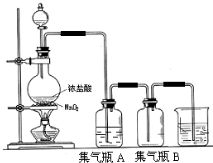 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O 和间苯二胺
和间苯二胺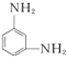 在一定条件下以等物质的量缩聚而成.写出Nomex纤维的结构简式:
在一定条件下以等物质的量缩聚而成.写出Nomex纤维的结构简式: .
.
 .
.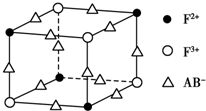 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.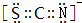 .
.