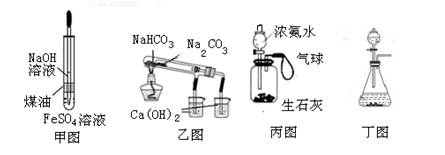
题目内容
某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理。(装置气密性已检查完毕)。
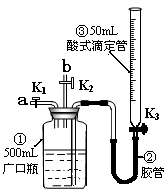
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作: ;
②从导管a通入一定量的NO,并记录滴定管读数,求出液面变化的数值为VL(V<50mL,气体体积已换算为标准状况)。准确测定NO的体积的主要操作: ;
(2)验证NO的还原性;探究工业生产硝酸的原理
①、停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是 ,写出对应现象的化学反应方程式 、 ;
②、继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i 当通入氧气的体积为1/2V时,则广口瓶①的气体体积为 ;
ii 当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为 mol/L。

(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作: ;
②从导管a通入一定量的NO,并记录滴定管读数,求出液面变化的数值为VL(V<50mL,气体体积已换算为标准状况)。准确测定NO的体积的主要操作: ;
(2)验证NO的还原性;探究工业生产硝酸的原理
①、停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是 ,写出对应现象的化学反应方程式 、 ;
②、继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i 当通入氧气的体积为1/2V时,则广口瓶①的气体体积为 ;
ii 当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为 mol/L。
(每空2分)
(1)①打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排出(或者让水充满①)且调节滴定管中液面与①相平并记录滴定管的刻度。
②关闭K2、打开K3、K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管的刻度。(未打开或关闭,此空0分)
(2)①气体先变为红棕色, (1分) 然后逐渐变淡。(1分),
2NO + O2 = 2NO2 ,3NO2 + H2O = 2HNO3 + NO 。
②______ V/3_______________,___________ V/11.2 mol/L __
(1)①打开K2、K3(或K1、K3或K1、K2、K3均打开),从滴定管加水,直到将①中空气全部排出(或者让水充满①)且调节滴定管中液面与①相平并记录滴定管的刻度。
②关闭K2、打开K3、K1,通入NO并调整滴定管液面与①中液面相平,再次记录滴定管的刻度。(未打开或关闭,此空0分)
(2)①气体先变为红棕色, (1分) 然后逐渐变淡。(1分),
2NO + O2 = 2NO2 ,3NO2 + H2O = 2HNO3 + NO 。
②______ V/3_______________,___________ V/11.2 mol/L __
略

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
 l2有无漂白性。
l2有无漂白性。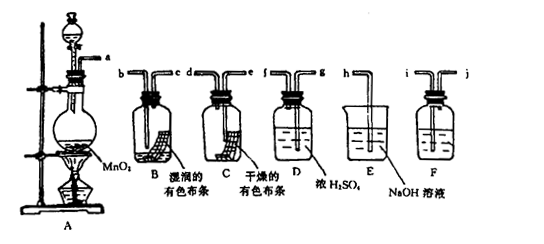
 。
。 红色布条的现象可得出的结论是
红色布条的现象可得出的结论是