题目内容
12.下列现象不能用氢键解释的是( )| A. | 冰的密度小于液态水 | B. | NH3容易液化 | ||
| C. | NH3极易溶于水 | D. | HF分子比HCl分子稳定 |
分析 N、O、F元素的电负性较强,对应的氢化物可形成氢键,氢键是一种较强的分子间作用力,是由电负性强的原子(如F,O,N)对氢原子的吸引力产生的,能够影响物质的熔点、沸点、密度等,以此解答该题.
解答 解:A.冰中含有氢键,其体积变大,则质量不变时冰的密度比液态水的密度小,故A不选;
B.氨气分子之间能形成氢键,沸点高,因此易液化,故B不选;
C.水分子与甲醇分子之间能形成氢键,则甲醇极易溶于水,故C不选;
D.由于F元素的非金属性较Cl元素强,氢气和氟气化合比氢气和氯气化合更容易,则生成的气态氢化物的稳定性越强,与分子间氢键无关,故D选.
故选D.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
2.下列离子方程式与所述事实相符且正确的是( )
| A. | 向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2═2I2+2H2O | |
| D. | 向硝酸铵溶液中滴加NaOH溶液:NH4++OH-═NH3↑+H2O |
3.海水中蕴藏着丰富的资源.海水综合利用的示意图如图:下列说法正确的是( )
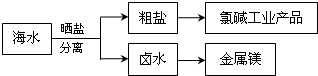

| A. | 通过氯碱工业可生产的产品仅仅为NaOH、Cl2 | |
| B. | 除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→适量盐酸 | |
| C. | 可将MgCl2•6H2O晶体在空气中直接加热脱水得到较纯净的无水MgCl2 | |
| D. | 电解MgCl2溶液可制取金属镁 |
4.下列方程式正确的是( )
| A. | AlCl3 溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| D. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
1.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从活塞放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 两种互不相溶,密度也不相同的液体可以用分液漏斗分离,例如苯和水 |
2.下列金属单质能与硫酸铜溶液反应且不产生气体的是( )
| A. | 金 | B. | 银 | C. | 钠 | D. | 锌 |
