题目内容
在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应X(g)+ Y(g)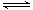 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表( )
| t / min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
C
解析试题分析:A、 Y的反应速率为v(Y)=(0.16-0.12)mol/(10L*2mim)=2.0×10-3mol/L,v(Z)=2v(Y)=4.0×10-3 mol/L。;B. ΔH<0,放热反应,降温正反速率均降低,降温反应向正向移动,V(正)>V(逆) ;C、列出三行式,由平衡常数公式可得K="1.44" ;D. 反应前后计量数不变,达到等效平衡,X体积分数不变。
考点:化学反应速率及化学平衡移动

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
C+CO2 2CO △H 1>0,反应速率v1 ,N2+3H2
2CO △H 1>0,反应速率v1 ,N2+3H2 2NH3 △H 2<0,反应速率v2 。若升高温度,v1和v2的变化是
2NH3 △H 2<0,反应速率v2 。若升高温度,v1和v2的变化是
| A.同时增大 | B.同时减少 | C.v1增大,v2减少 | D.v1减少,v2增大 |
某可逆反应aA + bB cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
cC + Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为( )
A.写成2aA + 2bB 2cC,Q值、K值均扩大了一倍 2cC,Q值、K值均扩大了一倍 |
B.写成2aA + 2bB 2cC,Q值扩大了一倍,K值保持不变 2cC,Q值扩大了一倍,K值保持不变 |
C.写成cC aA + bB,Q值、K值变为原来的相反数 aA + bB,Q值、K值变为原来的相反数 |
D.写成cC aA + bB,Q值变为原来的相反数,K值变为倒数 aA + bB,Q值变为原来的相反数,K值变为倒数 |
在密闭容器中发生反应:aX(g)+bY(g)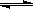 cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到
原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是
| A.平衡向正反应方向移动 | B.(a+b)>(c+d) |
| C.Z的体积分数变大 | D.X的转化率变小 |
在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是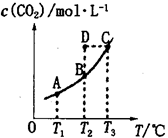
| A.平衡状态A与C相比,平衡状态A的c(CO)小 |
| B.在T2时,若反应处于状态D,则一定有v正<v逆 |
C.反应CO(g)+H2O(g) CO2(g)+H2(g)△H>0 CO2(g)+H2(g)△H>0 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
下列有关说法正确的是
| A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C.生铁中含有碳,抗腐蚀能力比纯铁强 |
| D.Zn具有还原性和导电性,可用作碱性锌锰干电池的负极材料 |
在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )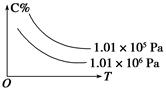
| A.ΔH<0 ΔS>0 | B.ΔH>0 ΔS<0 |
| C.ΔH>0 ΔS>0 | D.ΔH<0 ΔS<0 |
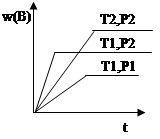
 cC(g) ΔH ="Q" 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是
cC(g) ΔH ="Q" 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是