题目内容
【题目】下列说法或表示方法正确的是( )
A. 等质量的硫粉分别在空气、氧气中完全燃烧,硫粉在氧气燃烧放出的热量多
B. 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
C. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l)△H=-285.8kJ·mol-1
2H2O(l)△H=-285.8kJ·mol-1
D. 在稀溶液中,H+(aq)+OH-(aq)![]() H2O(l)△H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,整个过程放出的热量大于57.3kJ
H2O(l)△H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,整个过程放出的热量大于57.3kJ
【答案】D
【解析】A. 等质量的硫粉分别在空气、氧气中完全燃烧,生成物均是二氧化硫,放出的热量一样多,A错误;B.硫蒸气所含能量比硫固体高,所以等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量多,B错误;C.2g氢气是1mol,放出285.8 kJ热量,则热化学方程式应为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1,C错误;D.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,为57.3kJ/mol,浓硫酸溶解时放热,所以将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ,D正确,答案选D。

【题目】今有下列三组物质,每组中都有一种物质跟其他三种属于不同的种类。将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。三组物质分别为:(1)O2、F2、S、N2;(2)Fe、Na、Al、Si;(3)MgO、CuO、FeO、P。(仿照第一组填写)
组别 | 被选出的物质 | 挑选依据 |
第(1)组 | S | 其它三种为气体 |
第(2)组 | ______ | ______ |
第(3)组 | ______ | ______ |
【题目】利用钻渣[含Co(OH)2、Fe2O3、Al2O3、MnO等)可以来制取钻的氧化物和CoCl2·6H2O,工艺流程如图所示:
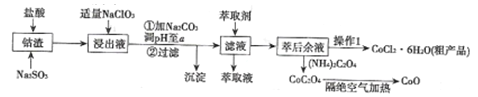
①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为________。
(2)流程中加人适量的NaClO3的作用是___________。若加入NaClO3过量,可能产生有毒气体,写出生成该有毒气体的离子方程式___________________。
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是___________。沉淀的主要成分是______。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是________;其使用的最佳pH范围是________。
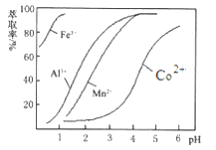
A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是______、______和过滤。
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为_______________。