题目内容
下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH +HCO
+HCO =BaCO3↓+NH3·H2O+H2O
=BaCO3↓+NH3·H2O+H2O
B.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
C.向碳酸氢铵溶液中加过量石灰水并加热:NH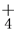 +OH-
+OH- NH3↑+H2O
NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2MnO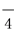 +6H++H2O2===2Mn2++3O2↑+4H2O
+6H++H2O2===2Mn2++3O2↑+4H2O
 53随堂测系列答案
53随堂测系列答案实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后2位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用 操作,然后轻轻挤压玻 璃球使尖嘴部分充满碱液。 (4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液, (填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式 。
Ⅲ、某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw



 环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。
环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。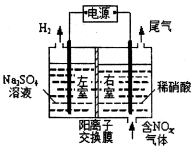
 从废料中回收氧
从废料中回收氧
 2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因。
2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因。 +4H+
+4H+ 列说法正确的是:[
列说法正确的是:[ Sn2+(aq) + Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq) + Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是