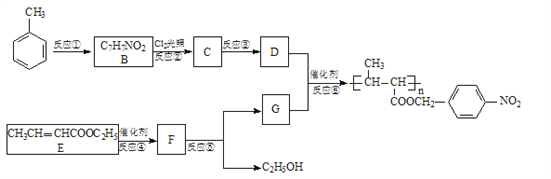
题目内容
【题目】某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含最/mg·L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
利用电渗析法技术可将海水淡化,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。下列说法中不正确的是

A. 电解一段时阳后阴极区会发生反应:Ca2++OH-+HCO3-==CaCO3↓+H2O
B. 阳极的电极反应式为2H2O-4e-=O2+4H+
C. 电解时b室中阴离子移向a室,阳离子移向c室
D. 淡水的出口为b出口
【答案】B
【解析】A、电解时阴极反应为2H++2e-=H2↑,消耗的H+来源于水,电解过程中生成OH-,所以发生反应Ca2++OH-+HCO3-=CaCO3↓+H2O,A描述正确。B、阳极Cl-还原性更强,电极反应为2Cl--2e-=Cl2↑,B描述错误。C、由于阴离子交换膜只能允许阴离子通过,而阳离子交换膜只能允许阳离子通过,所以电解时,图中b室的阴离子只能通过左侧阴离子交换膜进入a室,b室的阳离子只能通过右侧阳离子交换膜进入c室,C描述正确。D、当b室中的阴、阳离子分别进入a、c室后,从b室导出的水中不再含有上述离子,从而使海水得到淡化,D描述正确。正确答案B。

练习册系列答案
相关题目