题目内容
【题目】镁、钡是位于同一主族的活泼的金属元素。
回答下列问题:
(1)镁在元素周期表中的位置是:______________;钡位于周期表第六周期,钡原子最外层电子的电子排布式是:________。
(2)铝也是一种活泼金属,铝的金属性比钡的_____(填“强”或“弱”)。工业上可用如下方法制取钡:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,该法制钡的主要原因是______(选填选项)
3Ba↑+BaO·Al2O3,该法制钡的主要原因是______(选填选项)
a.高温时Al的活泼性大于Ba b.高温时BaO·Al2O3比Al2O3稳定
c.Ba的沸点比Al的低 d.高温有利于BaO分解
两个烧杯分别盛有VmL、c mol/L的Ba(OH)2溶液,分别向其中滴入c mol/L的H2SO4 和NaHSO4溶液,两烧杯中溶液导电能力随滴入溶液体积的变化分别如下图中①、②所示。
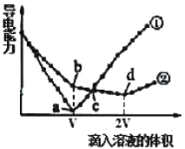
(3)写出Ba(OH)2溶液与H2SO4恰好反应的离子方程式:___________。
(4)写出b点溶液中大量存在的阴离子的电子式:_________。
(5)a、b、c、d点溶液呈中性的是____________________。
【答案】 第三周期、第ⅡA族 6s2 弱 c Ba2++2OH-+2H++SO42-→BaSO4↓+H2O ![]() a、d
a、d
【解析】试题分析:(1)根据元素周期表的结构分析;(2)根据元素性质递变规律分析;(3)根据高温条件下Al、Ba的状态回答;(3)Ba(OH)2溶液与H2SO4恰好反应生成硫酸钡和水;滴入vmL硫酸时曲线①导电性为0,说明滴入vmL硫酸时,氢氧化钡与硫酸的物质的量比为1:1
解析:(1)镁是12号元素,在元素周期表中的位置是第三周期、第ⅡA族;(2)同主族元素从上到下金属性增强,铝的金属性比钡的弱;镁、钡是位于同一主族,钡位于周期表第六周期,钡原子最外层有2个电子,最外层电子的电子排布式是6s2 ;(3)根据方程式,相同条件下Ba是气态,Ba的沸点比Al的低,所以可用2Al+4BaO=3Ba↑+BaO·Al2O3制钡 ;(3)Ba(OH)2溶液与H2SO4恰好反应生成硫酸钡和水,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O ;(4)滴入vmL溶液时曲线①导电性为0,说明曲线①为滴入硫酸的曲线,滴入vmL硫酸时,氢氧化钡与硫酸恰好完全反应,硫酸与氢氧化钡的物质的量比为1:1;则曲线②为氢氧化钡中滴入NaHSO4的曲线,b点NaHSO4与氢氧化钡的物质的量比为1:1,反应方程式为NaHSO4+Ba(OH)2═BaSO4↓+H2O+NaOH,所以b点溶液中大量存在的阴离子是OH-,电子式为![]() ;(5)a点硫酸与氢氧化钡恰好完全反应溶液呈中性、c点硫酸过量,溶液呈酸性,b点生成氢氧化钠溶液呈碱性,d点NaHSO4与氢氧化钡的物质的量比为2:1,反应方程式为2NaHSO4+Ba(OH)2═BaSO4↓+2H2O+Na2SO4,溶液呈中性,故a、d两点溶液呈中性。
;(5)a点硫酸与氢氧化钡恰好完全反应溶液呈中性、c点硫酸过量,溶液呈酸性,b点生成氢氧化钠溶液呈碱性,d点NaHSO4与氢氧化钡的物质的量比为2:1,反应方程式为2NaHSO4+Ba(OH)2═BaSO4↓+2H2O+Na2SO4,溶液呈中性,故a、d两点溶液呈中性。

 阅读快车系列答案
阅读快车系列答案【题目】某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含最/mg·L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
利用电渗析法技术可将海水淡化,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。下列说法中不正确的是

A. 电解一段时阳后阴极区会发生反应:Ca2++OH-+HCO3-==CaCO3↓+H2O
B. 阳极的电极反应式为2H2O-4e-=O2+4H+
C. 电解时b室中阴离子移向a室,阳离子移向c室
D. 淡水的出口为b出口
