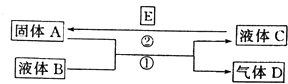
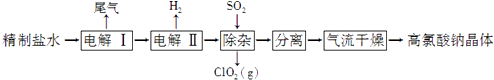
题目内容
【题目】1.92g Cu片与一定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用.则:
(1)反应中消耗HNO3mol,转移电子mol.
(2)用排水法收集生成的气体,最后气体的体积为L(标准状况).
(3)向收集到的气体中通入mL O2(标准状况)才能使水刚好充满整个集气容器.
【答案】
(1)0.11;0.06
(2)0.448
(3)336
【解析】解:发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,(1)n(Cu)= ![]() =0.03mol,n(气体)=
=0.03mol,n(气体)= ![]() =0.05mol,由原子守恒可知,n(HNO3)=2n(Cu)+n(气体)=0.06mol+0.05mol=0.11mol;由Cu元素的化合价变化可知,转移电子为0.03mol×(2﹣0)=0.06mol,所以答案是:0.11;0.06;(2)设NO、NO2的物质的量分别为x、y,则
=0.05mol,由原子守恒可知,n(HNO3)=2n(Cu)+n(气体)=0.06mol+0.05mol=0.11mol;由Cu元素的化合价变化可知,转移电子为0.03mol×(2﹣0)=0.06mol,所以答案是:0.11;0.06;(2)设NO、NO2的物质的量分别为x、y,则 ![]() ,解得x=0.005mol,y=0.045mol,用排水法收集生成的气体,发生3NO2+H2O=2HNO3+NO,生成n(NO)=0.045mol×
,解得x=0.005mol,y=0.045mol,用排水法收集生成的气体,发生3NO2+H2O=2HNO3+NO,生成n(NO)=0.045mol× ![]() =0.015mol,则共收集NO为0.015mol+0.005mol=0.02mol,其标况下体积为0.02mol×22.4L/mol=0.448L,所以答案是:0.448;(3)能使水刚好充满整个集气容器,则Cu失去电子被硝酸得到转化为NO2和NO,NO2和NO与氧气反应,提供给氧气电子全部转化为硝酸,两个过程中,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,由电子守恒可知,需要氧气为
=0.015mol,则共收集NO为0.015mol+0.005mol=0.02mol,其标况下体积为0.02mol×22.4L/mol=0.448L,所以答案是:0.448;(3)能使水刚好充满整个集气容器,则Cu失去电子被硝酸得到转化为NO2和NO,NO2和NO与氧气反应,提供给氧气电子全部转化为硝酸,两个过程中,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,由电子守恒可知,需要氧气为 ![]() =0.015mol,标况下的体积为0.015mol×22.4L/mol=0.336L=336mL,所以答案是:336.
=0.015mol,标况下的体积为0.015mol×22.4L/mol=0.336L=336mL,所以答案是:336.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案