题目内容
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等.
(1)下列△H表示物质标准燃烧热的是 ;表示中和反应反应热的是 .(填“△H1”、“△H2”、“△H3”等)
A.2H2(g)+O2(g)═2H2O(l)△H1B.C(s)+![]() O2(g)═CO(g)△H2=﹣Q1kJmol﹣1
O2(g)═CO(g)△H2=﹣Q1kJmol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3D.C(s)+O2(g)═CO2(g)△H4=﹣Q2kJmol﹣1
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的热化学方程式: .
(3)根据题(1)中B、D判断1molCO(g)完全燃烧的△H= .
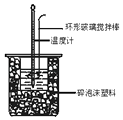
(4)反应E的△H6可以用如图所示的装置进行测量.实验中直接测定的数据是 ;从实验装置上看,图中尚缺少的一种玻璃用品是 ;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值 (填“偏大”“偏小”或“无影响”).
【答案】△H4;△H5;2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=﹣2589.6kJ?mol﹣1;(Q1﹣Q2)kJ?mol﹣1;温度;环形玻璃搅拌棒;偏小
【解析】(1)A.2H2(g)+O2(g)═2H2O(l)△H1中氢气的物质的量不是1mol,所以△H1不能表示燃烧热,故A错误;
B.C(s)+![]() O2(g)═CO(g)△H2=﹣Q1kJmol﹣1 , 生成产物不是最稳定氧化物,所以△H2不能表示燃烧热,故B错误;
O2(g)═CO(g)△H2=﹣Q1kJmol﹣1 , 生成产物不是最稳定氧化物,所以△H2不能表示燃烧热,故B错误;
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3 , 生成水为气体,不是最稳定氧化物,所以△H3不能表示燃烧热,故C错误;
D.C(s)+O2(g)═CO2(g)△H4=﹣Q2kJmol﹣1 , 碳的物质的量为1mol生成物二氧化碳为稳定氧化物,所以△H5能表示燃烧热,故D正确;
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5 , 符合中和热定义,△H5能表示中和反应反应热,故E正确;
所以答案是:△H4;△H5;
(2)C2H2气体完全燃烧反应的化学方程式为:2C2H2+5O2 ![]() 4CO2+2H2O,2.00g C2H2气体n(C2H2)=
4CO2+2H2O,2.00g C2H2气体n(C2H2)=![]() mol,放出99.6kJ的热量,则1molC2H2燃烧放出的热量为:99.6kJ×13=1294.8KJ,则热化学方程式为:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=﹣2589.6kJmol﹣1;
mol,放出99.6kJ的热量,则1molC2H2燃烧放出的热量为:99.6kJ×13=1294.8KJ,则热化学方程式为:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=﹣2589.6kJmol﹣1;
所以答案是:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=﹣2589.6kJmol﹣1;
(3)依据盖斯定律D﹣B的CO(g)+![]() O2(g)=CO2(g),所有反应的焓变为△H=(Q1﹣Q2)kJmol﹣1;
O2(g)=CO2(g),所有反应的焓变为△H=(Q1﹣Q2)kJmol﹣1;
所以答案是:(Q1﹣Q2)kJmol﹣1;
(4)反应E的△H6可以用如图所示的装置进行测量.实验中直接测定的数据是温度;
量热计应带环形玻璃搅拌棒;大烧杯上如不盖硬纸板,导致热量损失,所有求得的中和反应的反应热的数值偏小;
所以答案是:温度;环形玻璃搅拌棒;偏小.
【考点精析】本题主要考查了燃烧热的相关知识点,需要掌握在101kPa时1mol H2物质完全燃烧生成稳定的氧化物时所放出的能量,叫该物质的燃烧热才能正确解答此题.

【题目】某化学小组准备用环己醇制备环己烯,查得相关资料如下.反应原理:  反应物与产物的物理性质:
反应物与产物的物理性质:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为 .
(2)根据上述资料,装置(A,B,C)最适宜用来完成本次制备实验. 
(3)制备粗产品 将5mL加入试管A中,再加入10m , 摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯 ①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是;分液时,环己烯应从分液漏斗的(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 .