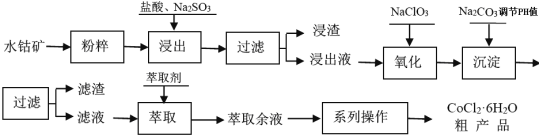
题目内容
【题目】将1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是1∶2
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL
【答案】A
【解析】
试题分析:A、设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06、64x+24y=1.52,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1,A错误;B、该浓硝酸的物质的量浓度为c=![]() =
=![]() =14mol/L,B正确;C、NO2和N2O4混合气体的物质的量为1.12L÷22.4L/mol=0.05mol,设二氧化氮的物质的量为a mol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,NO2和N2O4 的物质的量之比=0.04mol:(0.05mol-0.04mol)=4:1,因此NO2的体积分数是80%,C正确;D、硝酸的物质的量是0.7mol,NO2和N2O4的物质的量分别是0.04mol和0.01mol,则根据氮元素守恒可知硝酸钠的物质的量是0.7mol-0.04mol-0.01mol×2=0.64mol,所以根据钠离子守恒可知氢氧化钠的物质的量是0.64mol,其体积是640mL,D正确,答案选A。
=14mol/L,B正确;C、NO2和N2O4混合气体的物质的量为1.12L÷22.4L/mol=0.05mol,设二氧化氮的物质的量为a mol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,NO2和N2O4 的物质的量之比=0.04mol:(0.05mol-0.04mol)=4:1,因此NO2的体积分数是80%,C正确;D、硝酸的物质的量是0.7mol,NO2和N2O4的物质的量分别是0.04mol和0.01mol,则根据氮元素守恒可知硝酸钠的物质的量是0.7mol-0.04mol-0.01mol×2=0.64mol,所以根据钠离子守恒可知氢氧化钠的物质的量是0.64mol,其体积是640mL,D正确,答案选A。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案