题目内容
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是 。
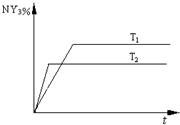
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g) 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
(3)X的非金属性比M (填“强”或“弱”),能证明此结论的事实是 (用离子方程式表示)。
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素的主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是 。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g)
 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
(3)X的非金属性比M (填“强”或“弱”),能证明此结论的事实是 (用离子方程式表示)。
(1)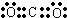 (1分);离子键和非极性共价键(1分);2Na2O2+2CO2=2Na2CO3+O2(2分)
(1分);离子键和非极性共价键(1分);2Na2O2+2CO2=2Na2CO3+O2(2分)
(2)<(1分);>(1分)(3)强(1分);SiO32-+CO2+H2O=CO32-+H2SiO3(胶体)(2分)
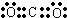 (1分);离子键和非极性共价键(1分);2Na2O2+2CO2=2Na2CO3+O2(2分)
(1分);离子键和非极性共价键(1分);2Na2O2+2CO2=2Na2CO3+O2(2分)(2)<(1分);>(1分)(3)强(1分);SiO32-+CO2+H2O=CO32-+H2SiO3(胶体)(2分)
试题分析:短周期元素X、Y、Z、M、N原子序数依次增大,X最外层电子数是次外层的2倍,则X为碳元素;Y元素主要化合价为-2价,则B为氧元素;Z其单质及化合物的焰色为黄色,则C为钠元素;M与X同主族,其单质为半导体材料,则M为硅元素;N其单质在Y单质中燃烧,发出明亮的蓝紫色火焰,则M为硫元素;
(1)根据共价化合物电子式的书写方法;根据过氧化钠的电子式来判断;根据过氧化钠能与二氧化碳反应生成碳酸钠和氧气;二氧化碳的电子式为
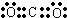 ;过氧化钠的电子式
;过氧化钠的电子式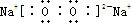 ,含有离子键和非极性共价键;过氧化钠能与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2
,含有离子键和非极性共价键;过氧化钠能与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2(2)由图可知,温度为T2先到达平衡,所以T1>T1,温度越高,NY3的体积分数减少,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应;根据化学平衡常数分别为K1、K2只与温度有关,平衡正向移动,平衡常数增大;
(3)同一主族,从上到下,元素的非金属性逐渐减弱;元素的非金属性越强,对应的最高价含氧酸的酸性越强以及强酸制弱酸来分析;碳元素的非金属性大于硅元素,则碳酸大于硅酸,碳酸能与可溶性硅酸盐反应生成硅酸和碳酸盐,离子方程式式为:SiO32-+CO2+H2O=CO32-+H2SiO3;

练习册系列答案
相关题目

 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

