题目内容
【题目】下表为元素周期表的一部分,请参照元素①﹣⑨在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)写出⑧的原子结构示意图 .
(2)④、⑤、⑥的原子半径由大到小的顺序为(用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(用化学式回答).
(4)②与④形成的原子个数比为1:2化合物的电子式为 .
(5)⑥的单质与①、④、⑤三种元素形成化合物的水溶液反应的离子方程式为: .
(6)②的最高价氧化物的熔沸点低于⑦的最高价氧化物的熔沸点,原因是 .
(7)⑤元素与⑨元素形成的化合物中,化学键类型为 , 高温灼烧该化合物时,火焰呈色.
(8)在②、③、⑦、⑧单质中,符合下列转化关系的是:(填元素符号).
【答案】
(1)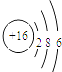
(2)Na>Al>O
(3)HNO3>H2CO3>H4SiO4
(4)![]()
(5)2Al+2OH﹣+2H2O=2AlO ![]() +3H2↑
+3H2↑
(6)CO2是分子晶体,SiO2是原子晶体,原子晶体中的共价键强于分子晶体中的分子间作用力,所以原子晶体熔沸点高于分子晶体的熔沸点
(7)离子键;黄
(8)C、N、S
【解析】解:根据元素在周期表中的分布,可以推知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是S,⑨是Cl.(1)硫原子结构示意图为: 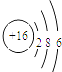 ,所以答案是:
,所以答案是: 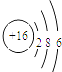 ;(2)电子层越多半径越大,所以O的半径最小,同周期从左到右原子半径逐渐减小,故Na>Al,所以答案是:Na>Al>O;(3)周期表中从左到右元素最高价氧化物对应水化物的酸的酸性逐渐增强,所以HNO3>H2CO3 , 周期表中从上到下元素最高价氧化物对应水化物的酸的酸性逐渐减弱,所以H2CO3>H4SiO4 , 所以答案是:HNO3>H2CO3>H4SiO4;(4)②与④形成的原子个数比为1:2化合物是二氧化碳,它是由碳原子和氧原子间通过共价键形成的非极性分子,其电子式为
;(2)电子层越多半径越大,所以O的半径最小,同周期从左到右原子半径逐渐减小,故Na>Al,所以答案是:Na>Al>O;(3)周期表中从左到右元素最高价氧化物对应水化物的酸的酸性逐渐增强,所以HNO3>H2CO3 , 周期表中从上到下元素最高价氧化物对应水化物的酸的酸性逐渐减弱,所以H2CO3>H4SiO4 , 所以答案是:HNO3>H2CO3>H4SiO4;(4)②与④形成的原子个数比为1:2化合物是二氧化碳,它是由碳原子和氧原子间通过共价键形成的非极性分子,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(5)金属铝是既能和强酸反应又能和强碱反应,和氢氧化钠反应的实质是:2Al+2OH﹣+2H2O=2AlO
;(5)金属铝是既能和强酸反应又能和强碱反应,和氢氧化钠反应的实质是:2Al+2OH﹣+2H2O=2AlO ![]() +3H2↑,所以答案是:2Al+2OH﹣+2H2O=2AlO
+3H2↑,所以答案是:2Al+2OH﹣+2H2O=2AlO ![]() +3H2↑;(6)②的最高价氧化物是二氧化碳,⑦的最高价氧化物是二氧化硅,二氧化碳的熔沸点低于二氧化硅的熔沸点,因为CO2是分子晶体,SiO2是原子晶体,原子晶体中的共价键强于分子晶体中的分子间作用力,所以原子晶体熔沸点高于分子晶体的熔沸点,所以答案是:CO2是分子晶体,SiO2是原子晶体,原子晶体中的共价键强于分子晶体中的分子间作用力,所以原子晶体熔沸点高于分子晶体的熔沸点;(7)钠元素与氯元素形成的化合物氯化钠中含有离子键,高温灼烧该化合物时,焰色反应火焰呈黄色,所以答案是:离子键;黄;(8)将C、N、S、Si代入上述转化关系中,当为Si时不成立,符合转化关系的是C、N、S,所以答案是:C、N、S.
+3H2↑;(6)②的最高价氧化物是二氧化碳,⑦的最高价氧化物是二氧化硅,二氧化碳的熔沸点低于二氧化硅的熔沸点,因为CO2是分子晶体,SiO2是原子晶体,原子晶体中的共价键强于分子晶体中的分子间作用力,所以原子晶体熔沸点高于分子晶体的熔沸点,所以答案是:CO2是分子晶体,SiO2是原子晶体,原子晶体中的共价键强于分子晶体中的分子间作用力,所以原子晶体熔沸点高于分子晶体的熔沸点;(7)钠元素与氯元素形成的化合物氯化钠中含有离子键,高温灼烧该化合物时,焰色反应火焰呈黄色,所以答案是:离子键;黄;(8)将C、N、S、Si代入上述转化关系中,当为Si时不成立,符合转化关系的是C、N、S,所以答案是:C、N、S.

 导学全程练创优训练系列答案
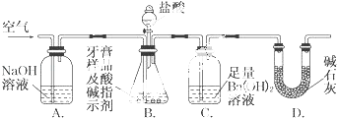
导学全程练创优训练系列答案【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是___________________________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于_________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_________。(提示:ΔH=-![]() ,保留一位小数)。
,保留一位小数)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”)。
【题目】某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: .
(2)实验结果表明,催化剂的催化效果与有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A,B,C三点所表示的反应速率最慢的是 .