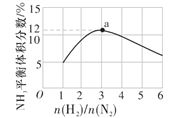
题目内容
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )
A.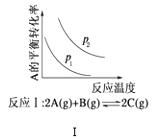 反应Ⅰ:△H>0,p2>p1
反应Ⅰ:△H>0,p2>p1
B.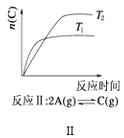 反应Ⅱ:△H>0,T1>T2
反应Ⅱ:△H>0,T1>T2
C. 反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
D.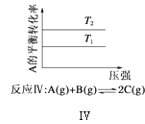 反应Ⅳ:△H<0,T2>T1
反应Ⅳ:△H<0,T2>T1
【答案】C
【解析】
A. 根据图象,A的平衡转化率随着温度的升高而降低,说明升高温度,平衡向逆反应方向进行,即正反应方向为放热反应,△H<0,作等温线,根据反应方程式,随着压强的增大,A的平衡转化率增大,即p2>p1,故A错误;
B. 根据图象,T1先达到平衡,说明T1>T2,随着温度升高,n(C)减小,升高温度,平衡向逆反应方向移动,即△H<0,故B错误;
C. 根据图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应为吸热反应△H>0,当T2<T1时,正反应为放热反应,△H<0,故C正确;
D. 根据图象,T2条件下A的转化率大,当T2>T1时,说明升高温度平衡向正反应方向进行,即正反应方向为吸热反应△H>0,故D错误;
答案:C。

 阅读快车系列答案
阅读快车系列答案【题目】钒钢具有高强度、弹性优良、抗磨损、抗冲击等性能,可用于汽车和飞机制造。一种从石煤(含SiO2、V2O3、V2O5和少量Fe2O3)中提取V2O5的流程如下图所示:
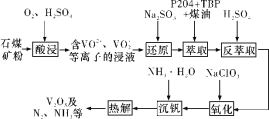
已知:
VO2+ | VO2+ | Fe2+ | Fe3+ | |
P2O4+TBP+煤油中的溶解度 | 很大 | 较小 | 0 | 很大 |
请回答下列问题:
(1)“酸浸”时,为提高浸出速率,除适当增加硫酸浓度、减小石煤矿粉粒径外,还可采取的措施有__________(任写一条);生成VO2+反应的离子方程式为_______。
(2)从整个流程来看,“还原”的目的为_______。
(3)实验室模拟“萃取”时,需用到的玻璃仪器有____________。
(4)“氧化”时发生反应的离子方程式为__________。
(5)上述流程中可以循环利用的物质有_________。
(6)全钒液流储能电池的工作原理为VO2++V3++H2O![]() VO2++V2++2H+。
VO2++V2++2H+。
①充电时,阳极的电极反应式为______;
②两极区被质子交换膜隔开,放电时,若外电路转移2mole-,则正极区溶液中n(H+)________(填“增加”或“减少”)________mol。