题目内容
溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
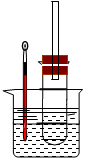
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。
(1)请写出该反应的化学方程式 。
(2)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)欲将生成的乙醇从反应混合物中进行分离出来,最简单的操作是 。
(4)请简述如何检验溴乙烷中含有溴元素 。
实验操作II:在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
(5)请写出该反应的化学方程式 。
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是 ,检验的方法是 (需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。

实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。
(1)请写出该反应的化学方程式 。
(2)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)欲将生成的乙醇从反应混合物中进行分离出来,最简单的操作是 。
(4)请简述如何检验溴乙烷中含有溴元素 。
实验操作II:在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
(5)请写出该反应的化学方程式 。
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是 ,检验的方法是 (需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
(1)CH3CH2Br + NaOH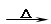 CH3CH2OH + NaBr (2分)
CH3CH2OH + NaBr (2分)
(2)混合物不分层 (1分)
(3)蒸馏 (1分)
(4)加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液有浅黄色沉淀生成(2分)
(5)CH3CH2Br + NaOH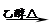 CH2=CH2 ↑+ NaBr + H2O (2分)
CH2=CH2 ↑+ NaBr + H2O (2分)
(6) CH2=CH2 ; (1分) 将生成的气体通入稀溴水,溴水褪色。(其他合理答案也可)(2分)
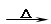 CH3CH2OH + NaBr (2分)
CH3CH2OH + NaBr (2分)(2)混合物不分层 (1分)
(3)蒸馏 (1分)
(4)加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液有浅黄色沉淀生成(2分)
(5)CH3CH2Br + NaOH
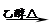 CH2=CH2 ↑+ NaBr + H2O (2分)
CH2=CH2 ↑+ NaBr + H2O (2分)(6) CH2=CH2 ; (1分) 将生成的气体通入稀溴水,溴水褪色。(其他合理答案也可)(2分)
试题分析:(1)溴乙烷在氢氧化钠的水溶液中发生取代反应生成乙醇和溴化钠,化学方程式为
CH3CH2Br + NaOH
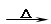 CH3CH2OH + NaBr ;
CH3CH2OH + NaBr ;(2)生成的产物乙醇与水互溶,所以混合物不分层现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)乙醇的沸点低,所以将乙醇从溶液中分离出来只能采用蒸馏的方法;
(4)检验溴乙烷中含有溴元素,需要硝酸银溶液,再加入硝酸银溶液前先加酸使溶液呈酸性,在加入硝酸银溶液,具体操作是加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液有浅黄色沉淀生成;
(5)溴乙烷在氢氧化钠的醇溶液中发生消去反应生成乙烯和溴化钠、水,化学方程式为
CH3CH2Br + NaOH
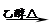 CH2=CH2 ↑+ NaBr + H2O;
CH2=CH2 ↑+ NaBr + H2O;(6)无论溴乙烷发生取代还是消去反应共同产物是溴化钠,所以证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,只能检验产物乙烯;检验的方法是将生成的气体通入稀溴水,溴水褪色;或通入酸性高锰酸钾溶液,紫色褪去。

练习册系列答案
相关题目
 ⑥CH2Cl2
⑥CH2Cl2

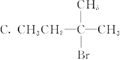 D .
D .