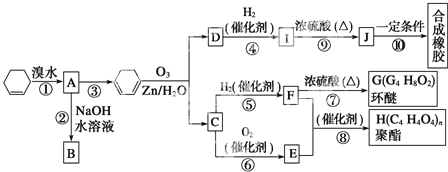
题目内容
【题目】A、B、C、D是位于短周期的主族元素。已知:①热稳定性:HmD>HmC; ②Cm+、E(m+1)+具有相同的电子层结构;③A与B在同一周期,在该元素所有主族中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子的3倍。
依据上述信息用相应的化学用语回答下列问题:
(1)B元素在周期表的位置_____________;
(2)HmDm的电子式______________;
(3)Cm-的结构示意图______________;
(4)AmDm的化学键类型_________;
(5)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为_________;
(6)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式____________________。
【答案】(1)第三周期IIIA族;
(2)![]()
(3)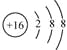
(4)离子键和共价键(或极性键)
(5) Cl2+2OH-=Cl-+ClO-+H2O;
(6)H2S+OH-=HS-+H2O
【解析】试题分析:在短周期所有主族元素中A的原子半径最大,则A为Na元素;A与B在同一周期,在该周期所有主族元素中,B的离子半径最小,则B为Al元素;A与B质子数之和是D质子数的3倍,D的质子数为:![]() ×(13+11)=8,则D为O元素;热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为S元素,m=2;Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素。
×(13+11)=8,则D为O元素;热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为S元素,m=2;Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素。
(1)B为Al元素,位于周期表的第三周期III族,故答案为:第三周期IIIA族;
(2)HmDm为H2O2,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)Cm-为S2-,结构示意图为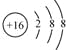 ,故答案为:
,故答案为: ;
;
(4)AmDm为Na2O2,过氧化钠为离子化合物,其电子式为:![]() ,含有离子键和共价键,故答案为:离子键和共价键;
,含有离子键和共价键,故答案为:离子键和共价键;
(5)E的单质为氯气,A与D形成的化合物的水溶液为NaOH溶液,在常温下氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)常温下,将等物质的量浓度的H2S溶液和NaOH溶液等体积混合,该反应的离子方程式为H2S+OH-=HS-+H2O,故答案为:H2S+OH-=HS-+H2O;

【题目】(1)H2S和H2Se的参数对比见右表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3° | -60.75 |
H2Se | 1.47 | 91.0° | -41.50 |
①H2Se的晶体类型为__________________;
②H2S的键角大于H2Se的原因可能__________________;
分子晶体
;;
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为___;(用元素符号表示)
(3)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____________1:3
;若该晶体的晶胞参数为a pm,则该合金密度
为_______________g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
(4)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁。
①1molFe(CO)5分子中含有σ键的数目为____________1:3
;
②该磁性氮化铁晶胞结构如图所示,该化合物的化学式____________。1:3
。。。