题目内容
14.配制一定浓度的氯化钠溶液时,下列操作会使所配溶液浓度偏高的是( )| A. | 溶液转移至容量瓶过程中不慎溅出 | |
| B. | 容量瓶中存在少量蒸馏水 | |
| C. | 溶液转移至容量瓶后,没有洗涤烧杯 | |
| D. | 定容时俯视刻度 |
分析 根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:A移液时不慎有溶液溅出,会导致溶质的损失,则溶液浓度偏低,故A错误;
B、若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故B错误;
C、没有洗涤烧杯会导致溶质的损失,则浓度偏低,故C错误;
D、定容时俯视刻度,会导致溶液体积偏小,则浓度偏高,故D正确.
故选D.
点评 本题考查了一定物质的量浓度溶液的配制过程中误差分析,属于基础型题目,难度不大,掌握操作基础是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列说法错误的是( )
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙醇分子中含有醛基 | |
| C. | 75%的乙醇溶液常用于医疗消毒 | |
| D. | 只用水就能鉴别苯和四氯化碳 |
5.甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C≡O):
①CH3OH(g)?CO(g)+2H2(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
由此计算△H1=+99kJ•mol-1.已知△H2=-58kJ•mol-1,则△H3=-41kJ•mol-1.
(2)在容积为1.00L的容器中,通入一定量的甲醇发生反应①.100℃时,体系中各物质浓度随时间变化如图1所示(平衡时甲醇的转化率记作a1).
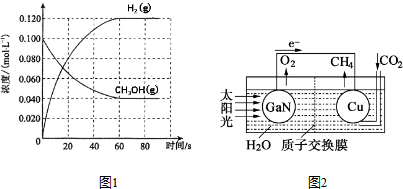
①在0-60s时段,反应速率v(CO)为0.001mol/(L•s)②;该反应的平衡常数K1 的计算式为$\frac{c(CO)c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$.
②已知若在恒压条件下进行,平衡时CH3OH的转化率a2大于a1(填“大于”或“小于”、“等于”),判断理由是因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动.
(3)合成CH4的原理:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.其他条件相同,实验测得在T1和P1与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,则P1>P2(填“>”、“<”或“=”).
(4)科学家用氮化镓材料与铜组装如图2所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4①写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O;.
②为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(选填“盐酸”或“硫酸”).
(5)标准状况下,将22.4L的甲烷完全燃烧生成的CO2通入到0.1L 1mol•L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
①CH3OH(g)?CO(g)+2H2(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在容积为1.00L的容器中,通入一定量的甲醇发生反应①.100℃时,体系中各物质浓度随时间变化如图1所示(平衡时甲醇的转化率记作a1).

①在0-60s时段,反应速率v(CO)为0.001mol/(L•s)②;该反应的平衡常数K1 的计算式为$\frac{c(CO)c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$.
②已知若在恒压条件下进行,平衡时CH3OH的转化率a2大于a1(填“大于”或“小于”、“等于”),判断理由是因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动.
(3)合成CH4的原理:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.其他条件相同,实验测得在T1和P1与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,则P1>P2(填“>”、“<”或“=”).
(4)科学家用氮化镓材料与铜组装如图2所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4①写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O;.
②为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(选填“盐酸”或“硫酸”).
(5)标准状况下,将22.4L的甲烷完全燃烧生成的CO2通入到0.1L 1mol•L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 0.1mol•L-1的HCl溶液:Ca2+、Na+、ClO-、NO3- |
9.下列叙述正确的是( )
| A. | 镍氢电池、锂电池和碱性锌锰干电池都是二次电池 | |
| B. | 氢氧燃料电池可将热能直接转变为电能 | |
| C. | 化学电池的反应本质是氧化还原反应 | |
| D. | 铅蓄电池放电时正极材料是Pb,负极材料是PbO2 |
19.人造地球卫星用到的一种高能电池--银锌蓄电池,其电极反应为:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-.据此判断,氧化银是( )
| A. | 正极,被还原 | B. | 正极,被氧化 | C. | 负极,被还原 | D. | 负极,被氧化 |
3.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 5.6 g 铁在足量氯气中燃烧,转移电子数为0.2 NA | |
| B. | 1mol H3O+所含的电子数为11NA | |
| C. | 71 g氯气与足量铁反应得到的电子数一定为2NA | |
| D. | 16 g O2和O3的混合气体中,含O2分子数为0.5NA |
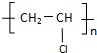 :
: