题目内容
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在
铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。反应一段时间后,停止加热。回答下列问题:
(1)写出a处反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)待试管中的液体冷却后,将试管上层液体倒去,再将剩余物质慢慢加入水中,可观察溶液呈 色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是 ,反应
的化学方程式为 。
(5)若用浓度为18 mol/L的浓硫酸100 mL与过量的铜片,加热使之反应,则被还原的硫酸(选填“大于”、“等于”或“小于”) 0.9 mol 。
(12分) (1)Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑(2分)
CuSO4+2H2O+SO2↑(2分)
(2)品红褪色(或者变浅)(1分)滤纸变红(恢复红色)(1分) (3)蓝色(2分)
(4)吸收二氧化硫,防止污染(2分) Na2CO3+SO2="=" Na2SO3+CO2(2分)
(5)小于(2分)
解析试题分析:(1)浓硫酸具有强氧化性,和铜反应的方程式是Cu+2H2SO4(浓)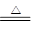 CuSO4+2H2O+SO2↑。
CuSO4+2H2O+SO2↑。
(2)SO2具有漂白性,能使品红溶液褪色,所以b处滤纸条的变化为品红褪色(或者变浅);又因为SO2的漂白是不稳定的,加热又恢复到原来的颜色,则滤纸条的变化为滤纸变红(恢复红色)。
(3)硫酸铜溶于水,溶液显蓝色。
(4)由于生成的SO2有毒,属于大气污染物,所以玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是吸收二氧化硫,防止污染,反应的方程式是Na2CO3+SO2="=" Na2SO3+CO2。
(5)由于随着反应的进行,浓硫酸的浓度逐渐减小,而稀硫酸与铜不反应,所以被还原的硫小于0.9mol。
考点:考查铜浓硫酸反应的有关判断和计算
点评:该题基础性强,紧扣教材,旨在巩固学生的基础,提高学生的应试能力和学习效率。有利于调动学生的学习兴趣,激发学生的学习积极性。该类试题主要是实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。

 某学生做浓硫酸性质的实验:
某学生做浓硫酸性质的实验: 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:

