题目内容
下列叙述中正确的是( )
| A.向Na2CO3饱和溶液中加入1.06g Na2CO3粉末,恢复至室温,析出2.86g Na2CO3·10H2O晶体 |
| B.向2mL CuSO4溶液中滴加2滴同浓度的NaOH溶液,向所得浊液中加入0.5 mL乙醛,加热至沸腾,有红色沉淀生成 |
| C.将1 L 2mol·L-1的FeCl3溶液加入到沸水中,加热使之形成红褐色液体,该液体中Fe(OH)3的胶粒数小于2NA |
| D.氢氧化铁胶体稳定存在的主要原因是胶粒做布朗运动,向其中滴加少量稀硫酸,将有沉淀产生 |
C
A项:1.06g Na2CO3所对应的Na2CO3·10H2O的质量是2.86g,但水减少后必然使原溶液中的部分Na2CO3也析出,晶体的质量大于2.86g;B项:CuSO4过量、NaOH不足,不符合实验要求(NaOH过量、碱性悬浊液),观察不到红色沉淀;C项:分散系中的分散质有Fe(OH)3、Fe3+,且胶粒是许多Fe(OH)3分子的聚集体,所以小于2NA;D项:胶体稳定的主要原因是胶粒带有电荷,互相排斥,而不是布朗运动,向Fe(OH)3胶体中滴加少量稀硫酸,胶体发生凝聚而形成沉淀,继续滴加,沉淀溶解。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目


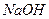 溶液,生成沉淀的物质的量与加入
溶液,生成沉淀的物质的量与加入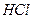 的发挥,则下列说法正确的是( )
的发挥,则下列说法正确的是( )