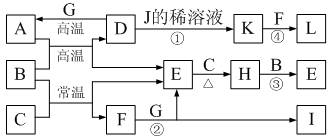
题目内容
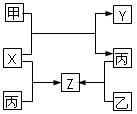
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示:

下面判断正确的是
A.原子半径: 丙<丁<戊 B金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙

下面判断正确的是
A.原子半径: 丙<丁<戊 B金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
C
同周期自左向右原子半径逐渐减小,金属性逐渐减弱,最高价氧化物的水化物的碱性逐渐减弱,A不正确,C正确。同主族自上而下金属性逐渐增强,B不正确。同周期自左向右最外层电子数逐渐增多,D不正确,答案选C。

练习册系列答案
相关题目