题目内容
【题目】被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:
TiO2+2C+2Cl2═TiCl4+2CO
(1)指出该反应的氧化剂 , 氧化产物;
(2)用双线桥法标出电子转移;
(3)当有6mol电子转移,则有mol还原剂被氧化.
【答案】
(1)Cl2;CO
(2)解:在反应中,C元素的化合价由0升高到+2价,失电子数目是2,Cl元素的化合价由0降低为﹣1价,得到电子数目共为2,Cl元素守恒,所以氯气前边系数是2,根据电子守恒,碳单质和一氧化碳前边系数都是2,根据钛元素守恒,所以二氧化钛前边系数是1,方程式为:TiO2+2C+2Cl2═TiCl4+2CO,电子转移情况如下: 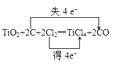 ,故答案为:
,故答案为: 
(3)3
【解析】解:(1)Cl元素的化合价降低,C元素的化合价升高,则Cl2为氧化剂,C为还原剂,CO是氧化产物,所以答案是:Cl2;CO;(3)根据化学方程式,当消耗2mol碳单质时,转移的电子为4mol,当有6mol电子转移,则有3mol还原剂C被氧化,所以答案是:3.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是 ( )
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略). 
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: .
装置B中饱和食盐水的作用是;
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为色,打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是 .
(3)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式: .
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |



