题目内容
铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是_____________;电解质溶液中H2SO4的浓度将变_____;当外电路通过1mol电子时,理论上负极板的质量增加______g。
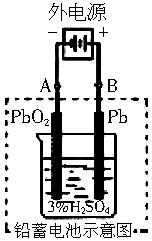
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池正负极的极性将_______。
(1)PbO2+4H++
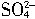 +2e-=PbSO4+2H2O;小;48
+2e-=PbSO4+2H2O;小;48(2)Pb;PbO2;互换
【试题分析】
本题主要考查了电化学知识和氧化还原反应知识,侧重考查了同学们的分析推理和知识迁移能力以及灵活运用知识的能力。
(1)铅蓄电池在放电时起原电池的作用,将化学能转变为电能,所以Pb作负极,其电极反应式为Pb+
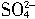 -2e-=PbSO4;PbO2作正极,其电极反应式为PbO2+4H++
-2e-=PbSO4;PbO2作正极,其电极反应式为PbO2+4H++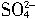 +2e-=PbSO4+2H2O。随着放电的进行,由总反应可知H2SO4的量减少,浓度变小;再根据负极反应式可知生成的PbSO4是白色沉淀,故负极板
+2e-=PbSO4+2H2O。随着放电的进行,由总反应可知H2SO4的量减少,浓度变小;再根据负极反应式可知生成的PbSO4是白色沉淀,故负极板增加的质量就等于
 的质量,因为PbSO4~2e-,所以,当外电路通过1mol电子时负极产生的PbSO4为0.5mol,因此,增加的质量为0.5mol
的质量,因为PbSO4~2e-,所以,当外电路通过1mol电子时负极产生的PbSO4为0.5mol,因此,增加的质量为0.5mol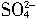 的质量,即48g。
的质量,即48g。(2)在充电时铅蓄电池起电解池作用,将电能转变为化学能。当完全放电耗尽PbO2和Pb时构成电解池,因A极接电源负极,所以A极是阴极,阴极发生还原反应,其电极反应为PbSO4+2e-=Pb+
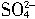 ,即PbSO4得电子生成Pb,则B极接电源正极,所以B极是阳极,发生氧化反应,其电极反应为PbSO4+2H2O-2e-=PbO2+4H++
,即PbSO4得电子生成Pb,则B极接电源正极,所以B极是阳极,发生氧化反应,其电极反应为PbSO4+2H2O-2e-=PbO2+4H++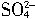 ,故这时正负极极性将互换。
,故这时正负极极性将互换。 
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4 铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O 铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为:
铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为: w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m 2PbSO4+2H2O
2PbSO4+2H2O