题目内容
(2012?石家庄一模)将Fe、FeO、Fe3O4混合物均分成两等份,在相同条件下,一份用足量氢气还原,参加反应的H2体积为V1;另一份用足量稀HNO3处理后,生成NO的体积为V2若V1:V2=3:1,则原混合物中Fe、FeO、Fe3O4的物质的量之比可能为( )
分析:混合物和氢气反应的过程是铁不反应,氧化亚铁和四氧化三铁与氢气反应生成铁,足量稀硝酸反应铁反应生成一氧化氮,氧化铁反应生成一氧化氮,四氧化三铁反应生成一氧化氮气体,依据氧化还原反应的电子守恒和气体体积比列式分析判断
解答:解:将Fe、FeO、Fe3O4混合物均分成两等份,在相同条件下,一份用足量氢气还原,参加反应的H2体积为V1;另一份用足量稀HNO3处理后,生成NO的体积为V2若V1:V2=3:1;设各组分中铁、氧化亚铁、四氧化三铁物质的量粉笔为:x、y、z;
铁和氢气不反应,依据电子守恒得到,FeO~H2,Fe3O4~4H2,y+4z=V1;
另一份用足量稀HNO3处理后,铁、氧化亚铁、四氧化三铁中的亚铁被氧化为铁离子,生成NO的体积为V2;
Fe~NO
x x
3FeO~NO
y
y
3Fe3O4~NO
z
z
(y+4z):(x+
y+
z)=3:1
得到x=z
选项中B符合;
故选B.
铁和氢气不反应,依据电子守恒得到,FeO~H2,Fe3O4~4H2,y+4z=V1;
另一份用足量稀HNO3处理后,铁、氧化亚铁、四氧化三铁中的亚铁被氧化为铁离子,生成NO的体积为V2;
Fe~NO
x x
3FeO~NO
y
| 1 |
| 3 |
3Fe3O4~NO
z
| 1 |
| 3 |
(y+4z):(x+
| 1 |
| 3 |
| 1 |
| 3 |
得到x=z
选项中B符合;
故选B.
点评:本题考查了铁及其化合物性质的分析计算应用,掌握物质性质和四氧化三铁组成,氧化还原反应电子守恒是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
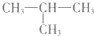 (2012?石家庄一模)2-甲基丙烷(如图)的二氯代物共有(不考虑立体异构)( )
(2012?石家庄一模)2-甲基丙烷(如图)的二氯代物共有(不考虑立体异构)( )