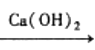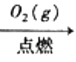题目内容
【题目】铝氢化钠(NaAlH4)是重要的还原剂。以铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3等杂质)为原料制备NaAlH4的一种流程如图:
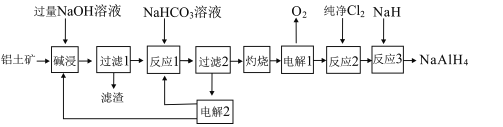
已知:碱浸中SiO2转化成难溶的Na2Al2SixO8
(1)Na2Al2SixO8用氧化物的形式表示为___(x用具体的数值表示)。
(2)过滤1得滤液的主要成分为NaOH和NaAlO2,写出反应1中NaHCO3与NaAlO2反应的离子方程式:___。
(3)电解2生成NaHCO3和NaOH用于循环使用,写出电解2阴极的电极反应式:___。
(4)反应3的化学方程式为___。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为___。
(6)滤渣主要成分有Na2Al2SixO8和Fe2O3,可以采用如图流程进行分离:

①滤渣溶于盐酸所得的固体物质可能为___(填化学式)。
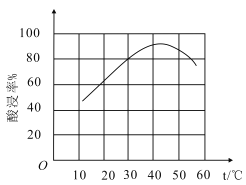
②滤渣溶于盐酸的“酸浸率”与温度关系如图所示,试解释温度过高,“酸浸率”降低的原因___。
③已知常温下,Ksp[Fe(OH)3]=8.0×10-38,Al3+开始沉淀的pH为4,(溶液中离子的浓度小于1×10-5mol/L为沉淀完全),从滤液中先分离出Fe3+,应调节pH范围为___(lg2≈0.3)。
【答案】Na2OAl2O32SiO2 HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- 2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑) ACl3+4NaH=NaAlH4+3NaCl NaAlH4+2H2O=NaAlO2+4H2↑ H2SiO3 温度过高,盐酸挥发损失,从而使“酸浸率”降低 3.3<pH<4
【解析】
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3、铝硅酸钠,碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,纯铝在氯气中燃烧生成氯化铝,氯化铝再与NaH反应生成氢化铝钠(NaAlH4),据此分析解答。
(1)由化合物化合价的代数和为0,得x=2,Na2Al2SixO8,用氧化物的形式表示为Na2OAl2O32SiO2;
(2)HCO3-与AlO2-反应生成氢氧化铝沉淀,反应的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-;
(3)电解2阴极产生H2,电极反应式为2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑);
(4)由图示知反应3为AlCl3与NaH反应,由原子守恒得另一种产物为NaCl,反应的方程式为ACl3+4NaH=NaAlH4+3NaCl;
(5)氢化铝钠遇水剧烈反应产生大量气泡,反应生成偏铝酸钠和氢气,反应的化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑;
(6)①Na2Al2SixO8为硅酸盐,与盐酸反应生成H2SiO3沉淀;
②由于盐酸易挥发,所以温度过高,滤渣溶于盐酸的“酸浸率”会降低;
③要使Fe3+完全沉淀,即c(Fe3+)<10-5mol/L,故c(OH-)>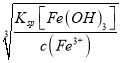 =
=![]() =2×10-11 mol/L,利用常温下水的离子积常数Kw=10-14,c(H+)=
=2×10-11 mol/L,利用常温下水的离子积常数Kw=10-14,c(H+)=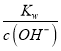 <5×10-4 mol/L,故pH>3.3,而Al3+开始沉淀时的pH为4,故pH范围为3.3<pH<4。
<5×10-4 mol/L,故pH>3.3,而Al3+开始沉淀时的pH为4,故pH范围为3.3<pH<4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
【题目】三氯化磷![]() 和三氯氧磷
和三氯氧磷![]() ,是两种重要的化工原料。
,是两种重要的化工原料。
(1)实验室制备![]() 的装置图(如图)和有关信息如下:
的装置图(如图)和有关信息如下:

物质 | 熔点/℃ | 沸点/℃ | 密度 | 性质 |
白磷 | 44.1 | 280.5 | 1.82 | 湿空气中约40℃着火 |
|
| 74.2 | 1.574 | 无色液体,遇水均剧烈水解,互溶 |
| 2.0 | 105.3 | 1.675 |
①实验开始先打开![]() 通入
通入![]() 排除装置内空气的目的是______________________。
排除装置内空气的目的是______________________。
②实验制得的粗产品中含有![]() ,可用_______方法提纯。
,可用_______方法提纯。
③![]()
![]() 和
和![]() ,水解后的溶液中除
,水解后的溶液中除![]() 之外其他离子的浓度由大到小的顺序是___________________________________(已知
之外其他离子的浓度由大到小的顺序是___________________________________(已知![]() 是二元弱酸)。
是二元弱酸)。
(2)实验室通常用![]() 直接氧化
直接氧化![]() 制备
制备![]() ,工业上通常采用潮湿的
,工业上通常采用潮湿的![]() 氧化
氧化![]() 制备
制备![]() ,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
,请写出工业制备的反应方程式:______________________________________。从原理上分析,实验室制备方法的优点是_________________________________________________(写出两点)。
(3)用![]() 标准溶液定量测定实验室制备的
标准溶液定量测定实验室制备的![]() 粗产品的纯度,实验步骤如下:
粗产品的纯度,实验步骤如下:
①取![]() 粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入
粗产品溶于水至完全水解,预处理排除磷酸根离子的影响,加入![]() 溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的
溶液,完全反应后加少量硝基苯,用力摇动,静置,使沉淀表面被有机物覆盖,防止实验测得的![]() 纯度___________(填“偏大”“偏小”或“不变”)。[已知:
纯度___________(填“偏大”“偏小”或“不变”)。[已知:![]() ]
]
②滴加![]() 作指示剂,用
作指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 溶液,当溶液__________________________,即为终点。共用去
溶液,当溶液__________________________,即为终点。共用去![]() 溶液,则粗产品中
溶液,则粗产品中![]() 的纯度为_________%(保留小数点后1位)。
的纯度为_________%(保留小数点后1位)。