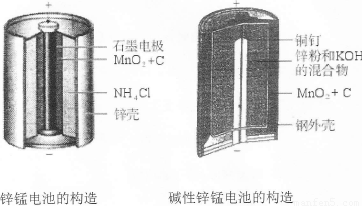
题目内容
锌一锰干电池的总反应式为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,下列说法
错误的是
A.电池负极(锌筒)的电极反应式为:Zn-2e-=Zn2+
B.电池正极(石墨)的电极反应式为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
C
解析:
此题考查原电池知识,原电池的原理及其应用是历年高考的热点。根据原电池的总反应式写各电极反应式,首先分析总反应式中得失电子情况,得出锌失电子,是负极;二氧化锰得电子,碳棒是正极,分析电极反应式A、B选项正确。C选项,在原电池的外电路电子是由负极流向正极,错。D选项外电路中每通过0.2mol电子,也就是锌失0.2mol电子,所以有0.1mol锌失电子,故锌的质量理论上减小6.5g,对。

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目