��Ŀ����
����Ŀ���о�̼���仯������ת������Դ�ij�����á���̼����������Ҫ�����á�
��1����֪:��CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ��H1=+206.1kJ��mol-1
CO(g)+3H2(g) ��H1=+206.1kJ��mol-1
��2H2(g)+CO(g) ![]() CH3OH(l) ��H2=-128.3kJ��mol-1
CH3OH(l) ��H2=-128.3kJ��mol-1
��2H2(g)+O2(g) ![]() 2H2O(g) ��H3=-483.6kJ��mol-1
2H2O(g) ��H3=-483.6kJ��mol-1
25��ʱ,�ں��ʵĴ���������,���ü��������һ���ϳ�Һ̬�״����Ȼ�ѧ����ʽΪ_________��
��2�����÷�Ӧ�����Ʊ�����,Ϊ��̽���¶ȡ�ѹǿ�Է�Ӧ�����ʡ�ת���ʵ�Ӱ��,ijͬѧ�������������Ա�ʵ��(�¶�Ϊ400���500��,ѹǿΪ101kPa��404kPa)��
ʵ����� | �¶ȡ� | ѹǿ/kPa | CH4��ʼŨ��/mol��L-1 | H2O��ʼŨ��/mol��L-1 |
1 | 400 | P | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
��ʵ��2��ʵ��3���,��ƽ�ⳣ����ϵ��K2______K3(�>������<����=��)��
�ڽ������ʵ�����CH4��ˮ��������1L�����ܱ�������,����������Ӧ,��400���´ﵽƽ��,ƽ�ⳣ��K=27,��ʱ������CO���ʵ���Ϊ0.10mol,��CH4��ת����Ϊ________��
��3����ѧ�������CO2��ȡC��̫���ܹ�����ͼ1��ʾ��
�١�����ϵͳ�������ķ�Ӧ��n(FeO):n(CO2)=6:1,��FexOy�Ļ�ѧʽΪ______________��
�ڡ��ȷֽ�ϵͳ����ÿ�ֽ�lmolFexOy,ת�Ƶ��ӵ����ʵ���Ϊ________��

��4��pC����pH,��ָ��ϡ��Һ�е�����Ũ�ȵij��ø�����ֵ����ij��Һ�����ʵ�Ũ��Ϊ1��10-3mol��L-1,�����Һ�����ʵ�pC=-lg(1��10-3)=3����ͼ2Ϊ25��ʱH2CO3��Һ��pC-pHͼ����ش���������(������Ũ��С��10-5mol/L,����Ϊ�����Ӳ�����):
����ͬһ��Һ��,H2CO3��HCO3-��CO32-_____________(��ܡ����ܡ�)�������档
����H2CO3һ������ƽ�ⳣ������ֵKa1=________________��
������ѪҺ����Ҫͨ��̼�����λ�����ϵc(H2CO3)/c(HCO3-)���Ե�����������,ά��pH=7.4���������������ѪҺ��ʱ,ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս�_______��
A.��� B.��С C.�������� D.���ж�
���𰸡� CH4(g)+1/2O2(g) ![]() CH3OH(l) ��H1=-164.0kJ/mol > 10/11(90.0%��90.91%��10/11��100%) Fe3O4 2mol ���� 1��10-6 A
CH3OH(l) ��H1=-164.0kJ/mol > 10/11(90.0%��90.91%��10/11��100%) Fe3O4 2mol ���� 1��10-6 A
����������1����֪:��CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ��H1=+206.1kJ��mol-1
CO(g)+3H2(g) ��H1=+206.1kJ��mol-1
��2H2(g)+CO(g) ![]() CH3OH(l) ��H2=-128.3kJ��mol-1
CH3OH(l) ��H2=-128.3kJ��mol-1
��2H2(g)+O2(g) ![]() 2H2O(g) ��H3=-483.6kJ��mol-1
2H2O(g) ��H3=-483.6kJ��mol-1
���ݸ�˹���ɣ��ɢ�+��+![]() ���۵ã�CH4(g)+
���۵ã�CH4(g)+ ![]() O2(g)
O2(g) ![]() CH3OH(l) ��H1=-164.0KJ/mol��
CH3OH(l) ��H1=-164.0KJ/mol��
��2����Ӧ�������ȷ�Ӧ���¶����ߣ���ѧƽ�������ƶ���Kֵ���ʵ��2���¶ȸ���ʵ��3������K2>K3����������ˮ����ʼ��Ϊx����������ʽ�У�
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼ����x x 0 0
ת������0.1 0.1 0.1 0.3
ƽ������x-0.1 x-0.1 0.1 0.3
��ƽ�ⳣ������ʽK=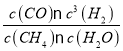 =
=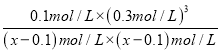 =27�����x=0.11����ƽ��ʱ�����ת����Ϊ��
=27�����x=0.11����ƽ��ʱ�����ת����Ϊ�� ![]() ��100%=90.9%��(3) ����ʾ��ͼ��֪��������ϵͳ����CO2��FeO��Ӧ����FexOy��C�������ķ�Ӧ��n(FeO):n(CO2)=6:1,����������ԭ���غ��֪x:y=6:(6+2)=3:4����FexOy�Ļ�ѧʽΪFe3O4�����ȷֽ���ϵ����Fe3O4�ֽ�ΪFeO���������ֽ�1mol Fe3O4ת�Ƶ��ӵ����ʵ���Ϊ1mol��3��(
��100%=90.9%��(3) ����ʾ��ͼ��֪��������ϵͳ����CO2��FeO��Ӧ����FexOy��C�������ķ�Ӧ��n(FeO):n(CO2)=6:1,����������ԭ���غ��֪x:y=6:(6+2)=3:4����FexOy�Ļ�ѧʽΪFe3O4�����ȷֽ���ϵ����Fe3O4�ֽ�ΪFeO���������ֽ�1mol Fe3O4ת�Ƶ��ӵ����ʵ���Ϊ1mol��3��(![]() -2)=2mol��(4) ��̼����ڵ���Һ�����Խ�ǿ��̼������Ӵ��ڵ���Һ�м��Խ�ǿ������̼������Ӻ�̼��ܴ������棻����ͼ���֪��PH=6ʱ��Pc(H2CO3)=Pc(HCO3-)�����Ka1(H2CO3)=
-2)=2mol��(4) ��̼����ڵ���Һ�����Խ�ǿ��̼������Ӵ��ڵ���Һ�м��Խ�ǿ������̼������Ӻ�̼��ܴ������棻����ͼ���֪��PH=6ʱ��Pc(H2CO3)=Pc(HCO3-)�����Ka1(H2CO3)=  =
=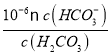 =1��10-6����������Ũ������ƽ�������ƶ��ų�������̼��̼��Ũ�Ȼ������䣬��c(H+)/c(H2CO3)���ս����ѡA��
=1��10-6����������Ũ������ƽ�������ƶ��ų�������̼��̼��Ũ�Ȼ������䣬��c(H+)/c(H2CO3)���ս����ѡA��



