��Ŀ����
����Ŀ��T��ʱ��A������B���巴Ӧ����C���塣��Ӧ������A��B��CŨ�ȱ仯��ͼ��������ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��B�����������ʱ��Ĺ�ϵ��ͼ��������ʾ�������н�����ȷ����
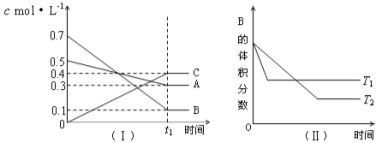
A������t1��10��minʱ�����������������䣬����ѹǿ��ƽ�����淴Ӧ�����ƶ�
B������t1��10��minʱ������������ѹǿ���䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ�
C��T��ʱ������ͬ�����У�����0.3mol��L��1 A ��0.1 mol��L��1 B��0.4 mol��L��1 C��Ӧ���ﵽƽ���C��Ũ����Ϊ0.4 mol��L��1
D�������������䣬�����¶ȣ������淴Ӧ���ʾ�������A��ת��������
���𰸡�C
��������
���������A����t1minʱ����Ӧ�ﵽƽ��״̬�����淴Ӧ������ȣ�����ַ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����A��g��+3B��g��=2C��g����2V����B��=3V����C������A������ B����t1+10��minʱ������ѹǿ���䣬ͨ��ϡ�����壬����������Ӧ����ռ��ѹ��С��ƽ�����������ķ����ƶ�����B������ C������ͼ��֪����ѧƽ�ⳣ��K= 0.42/0.3��13=1600/3������C��ƽ��Ũ����0.4mol/L��
A��g��+3B��g��=2C��g��
��ʼ��mol/L�� 0.3 0.1 0.4
�仯��mol/L�� 0 0 0
ƽ����mol/L�� 0.3 0.1 0.4
��ѧƽ�ⳣ��K��= 0.42/0.3��0.13=1600�������Է���ƽ�ⳣ��K����C��ȷ�� D�������������䣬�����¶ȣ����淴Ӧ���ʶ�����ƽ�������ȷ�Ӧ�����ƶ�������ͼ��֪������Ӧ�Ƿ��ȷ�Ӧ������ƽ�����淴Ӧ�����ƶ���A��ת���ʽ��ͣ���D����

 ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������ӦX(g) + Y(g)![]() 2Z(g) ��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z(g) ��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����
A. 0��2min��ƽ�����ʦ�(Z) = 2.0��10��3mol��L��1��min-1
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��(��)����(��)
C. ���¶��´˷�Ӧ��ƽ�ⳣ��K =1.44
D. �����������䣬�ٳ���0.2molZ��ƽ��ʱX�������������