题目内容
计算题:(7分)(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2 (g) + O2(g)  2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时, SO2的转化率应为多少?
 2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时, SO2的转化率应为多少?
(1) 0.22/ 0.22×0.9=1.1<K=19 未达到平衡,向正方向进行。(3分)
(2)(4分) 2SO2 + O2
 2SO3
2SO3起始浓度(mol/L) 0.4 1 0
转化浓度(mol/L) 2x x 2x
平衡浓度(mol/L) (0.4-2x) (1-x) 2x
依据平衡常数的定义,则:
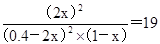 解得:x=0.16(mol/L)
解得:x=0.16(mol/L)SO2的转化率应为: 2×0.16/0.4×100%=80%
(1)用浓度熵判断:QC= 0.22/ 0.22×0.9=1.1<K=19 未达到平衡,向正方向进行。(3分)
(2)(4分)列出三段式,用平衡常数解。
2SO2 + O2
 2SO3
2SO3起始浓度(mol/L) 0.4 1 0
转化浓度(mol/L) 2x x 2x
平衡浓度(mol/L) (0.4-2x) (1-x) 2x
依据平衡常数的定义,则:
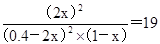 解得:x=0.16(mol/L)
解得:x=0.16(mol/L)SO2的转化率应为: 2×0.16/0.4×100%=80%

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
 C(g),A的含量和温度的关系如图所示,下列结论正确的是:
C(g),A的含量和温度的关系如图所示,下列结论正确的是:
 (注:x为P物质
(注:x为P物质 2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 CO(g) +H2(g) △H= +131.3kJ·mol-1
CO(g) +H2(g) △H= +131.3kJ·mol-1
 。请根据图示回答下列问题:
。请根据图示回答下列问题: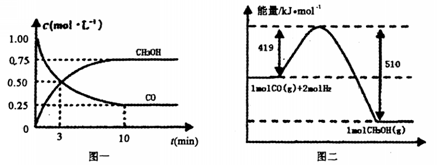
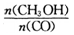 增大的有________________
增大的有________________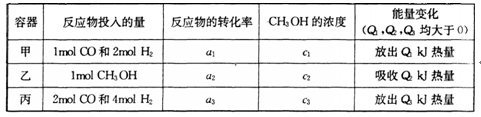
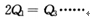
 2NH3反应,在下列比例中,生成NH3的量最多的是:
2NH3反应,在下列比例中,生成NH3的量最多的是: B(g)+3C(g)达到平衡时,A、B、C的物质的量分别是6mol,2mol,6mol.在保持温度和压强不变的条件下,下列说法正确的是
B(g)+3C(g)达到平衡时,A、B、C的物质的量分别是6mol,2mol,6mol.在保持温度和压强不变的条件下,下列说法正确的是 B + C在某一温度时,达到平衡。
B + C在某一温度时,达到平衡。 C均为气体,加入催化剂,平衡___________移动(填“正向”、“逆向”或“不”)
C均为气体,加入催化剂,平衡___________移动(填“正向”、“逆向”或“不”)