题目内容
【题目】实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
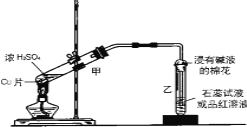
(1)写出甲装置中发生的主要反应的化学方程式____________________________。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是_________________________。
(3)生成的气体使品红溶液的颜色______________;实验完毕后,取少量乙试管中溶液于试管中加热,现象是________________;原因是__________________________________。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 吸收多余的SO2防止污染环境 由红色变无色 由无色变红色 SO2漂白时生成不稳定的无色物质
CuSO4+SO2↑+2H2O 吸收多余的SO2防止污染环境 由红色变无色 由无色变红色 SO2漂白时生成不稳定的无色物质
【解析】
(1)SO2具有漂白性,能使品红溶液褪色,即乙中品红褪成无色,说明有SO2生成。铜离子在溶液中显蓝色,据此可以说明有硫酸铜生成。铜和浓硫酸反应的方程式为
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)SO2有毒,是大气污染物,需要尾气处理,因此饱和碳酸钠的作用就是吸收多余的SO2防止污染环境,故答案为:吸收多余的SO2防止污染环境。
(3)由于SO2的漂白原理是和有色物质化合生成不稳定的无色物质,在加热的条件下,又能恢复用来的颜色,所以加热时溶液由无色变红色,故答案为:由红色变无色;由无色变红色;SO2漂白时生成不稳定的无色物质。

练习册系列答案
相关题目





