题目内容
3.(1)34g NH3共有8mol原子,0.1molH2S共约有1.204×1023个氢原子.同温同压下,等体积的NH3和H2S气体的质量比为1:2,含有的分子数目之比为1:1.(2)在标准状况下,35.5g Cl2的体积约是11.2L,将其与氢气完全化合生成氯化氢需氢气的物质的量是0.5mol.
(3)欲配制500mL 0.2mol/L Na2CO3溶液,需要用天平称量Na2CO3•10H2O晶体质量为28.6g.若从中取出10mL溶液加水稀释至20mL,则此溶液中Na+的物质的量浓度为0.2mol/L.
分析 (1)根据n=$\frac{m}{M}$计算氨气物质的量,每个氨气分子含有4个原子,据此计算所含原子物质的量;H2S含有氢原子物质的量为硫化氢的2倍,再根据N=nNA计算含有氢原子数目;同温同压下,体积之比等于物质的量之比,再根据m=nM计算质量之比,分子数目之比等于其物质的量之比;
(2)根据n=$\frac{m}{M}$计算氯气物质的量,再根据V=nVm计算氯气体积;根据Cl2+H2=2HCl计算需要氢气物质的量;
(3)根据n=cV计算碳酸钠物质的量,根据m=nM计算Na2CO3•10H2O的质量,根据稀释定律计算稀释后溶液中Na+的物质的量浓度.
解答 解:(1)34g 氨气物质的量为$\frac{34g}{17g/mol}$=2mol,含有原子物质的量为2mol×4=8mol;
0.1molH2S含有氢原子数目为0.1mol×2×6.02×1023mol-1=1.204×1023;
同温同压下,等体积的NH3和H2S气体的物质的量相等,由m=nM可知,二者质量比为17g/mol:34g/mol=1:2,二者分子数目之比为1:1,
故答案为:8;1.204×1023;1:2;1:1;
(2)在标准状况下,35.5g Cl2的物质的量为$\frac{35.5g}{71g/mol}$=0.5mol,体积约是0.5mol×22.4L/mol=11.2L,根据Cl2+H2=2HCl可知,需要氢气物质的量为0.5mol
故答案为:11.2;0.5;
(3)碳酸钠物质的量为0.5L×0.2mol/L=0.1mol,需要Na2CO3•10H2O的质量为0.1mol×286g/mol=28.6g,根据稀释定律,稀释后溶液中Na+的物质的量浓度为$\frac{0.2mol/L×2×0.01L}{0.02L}$=0.2mol/L,
故答案为:28.6g;0.2mol/L.
点评 本题考查物质的量的有关计算,难度不大,注意掌握以物质的量为中心的计算,有利于基础知识的巩固.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案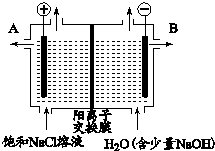
| A. | 左侧电极发生氧化反应 | |
| B. | 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝 | |
| C. | 电解一段时间后,B口排出NaOH溶液 | |
| D. | 电解饱和食盐水的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
| A. | S2-、I-、Br-、SO${\;}_{3}^{2-}$ | B. | S、I2、Br2、SO2 | ||
| C. | Fe2+、H+、NO${\;}_{3}^{-}$、MnO${\;}_{4}^{-}$ | D. | Fe3+、H+、Cu2+、Al3+ |
| A. | YO${\;}_{4}^{2-}$+2M2++4H+═YO2+2M3++2H2O | |
| B. | 5M2++XO${\;}_{4}^{-}$+8H+═5M3++X2++4H2O | |
| C. | 2XO${\;}_{4}^{-}$+10B-+16H+═2X2++5B2+8H2O | |
| D. | A2+2B-═B2+2A- |
| A. | 工业上在高温下可用CO还原含Fe2O3的铁矿石炼铁 | |
| B. | 铁在纯氧中燃烧或高温下与水蒸气反应均能得到Fe3O4 | |
| C. | 先滴加氯水,再滴加KSCN溶液后显红色证明溶液含有Fe2+ | |
| D. | 氯化铁溶液有较强氧化性,氯化铁也可用作净水剂 |
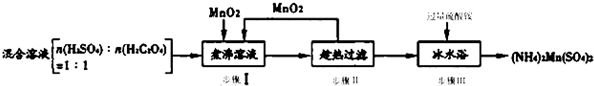
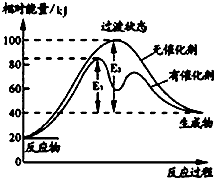
 只有C是金属,D的单质是黄色固体.
只有C是金属,D的单质是黄色固体. .
.