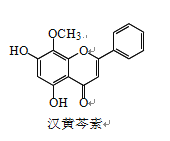
题目内容
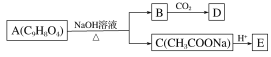
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:

(1)步骤②中发生反应的离子方程式为____________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是___________________________________。
(3)步骤⑤的操作为______________________________
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_____[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
【答案】2NH4++ MgO=Mg2++ 2NH3↑+ H2O 抑制Mg2+水解,以便得到更多更纯的产品 蒸发浓缩,冷却结晶 蓝色
【解析】
(1)MgO与硫酸铵溶液加热反应生成的气体与硫酸反应生成硫酸铵,说明该气体是氨气,则MgO与硫酸铵加热的产物中有氨气,说明MgO的加入,促进铵根离子的水解,生成氨气,得到的氢离子与MgO反应生成镁离子和水,所以步骤②中发生反应的离子方程式为2NH4++ MgO=Mg2++ 2NH3↑+ H2O;
(2)得到的硫酸镁溶液中镁离子水解,得不到较纯的硫酸镁晶体所以为抑制镁离子水解,步骤④中调节pH=6.0~6.5,以便得到更多更纯的产品;
(3)由溶液得到晶体需进行的操作是蒸发浓缩、冷却结晶,所以步骤⑤的操作为蒸发浓缩,冷却结晶;
(4)饱和的氢氧化镁溶液存在Mg(OH)2 (s)= Mg2+(aq) + 2 OH-(aq)溶解平衡,2c(Mg2+)= c(OH -),又溶度积Ksp= c(Mg2+)c2(OH -)=5.6×10-12 ,由此可以得出c(OH -)=2.24×10-4 ,c(H+)=1×10-14/2.24×10-4 =4.5×10-11,所以pH>9.6,所以加入百里酚蓝指示剂,溶液呈蓝色。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】如图是元素周期表的一部分,其中X、Y、Z均为短周期元素,它们的位置关系如图所示,已知三种元素的质子数之和为31,写出:
X | ||
Y | Z |
(1)写出X、Y、Z的元素符号:___、___、___。
(2)写出Y元素的离子结构示意图:___。
(3)元素Y和Z的金属性较强的是___(填元素符号)。
(4)Z是大自然赐予人类的宝物。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为___,Z表现出的性质是___(氧化性/还原性),反应时可观察到的实验现象有___(填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C.有熔融物生成
【题目】下列实验能达到实验目的的是( )
序号 | 实验内容 | 实验目的 |
A | 盛有 | 探究浓度对反应速率的影响 |
B | 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | 比较Br2 和I2的氧化性强弱 |
C | 在容积可变的密闭容器中发生反应:2NO2(g) | 正反应速率加快,逆反应速率减慢 |
D | 向2支试管中各加入相同体积、相同浓度的 | 探究温度对反应速率的影响 |
A.AB.BC.CD.D
【题目】I、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铁丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)经数据处理,测得中和热为56.8 kJ·mol-1其热化学方程式为:___________
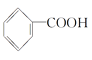
II.实验室制备硝基苯实验装置和步骤如下:(实验步骤)

取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是__________。
(4)在洗涤操作中,第二次水洗的作用是____________________。