题目内容
【题目】一定量的浓硝酸与足量的铜反应(后期加热),得到对氢气的相对密度为28的混和气体,该气体通过水后,体积缩小了1/3,则混和气体中含NO2的体积百分含量为多少?
【答案】33.3%
【解析】
浓硝酸与足量的铜发生的反应有:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,反应生成的气体NO2分子量为46,NO分子量为30,得到对氢气的相对密度为28的混合气体,平均分子量为56,说明此时存在2NO2![]() N2O4,即混合气体是NO2、N2O4、NO,设生成1mol混合气体,三者的物质的量分别为xmol、ymol、zmol,x+y+z=1 ①,平均相对分子质量为56,得46x+92y+30z=56 ②,气体通过水后,体积缩小了1/3,即最后气体体积为2/3,1分子N2O4相当于2分子NO2,则根据方程式3NO2+H2O=2HNO3+NO可知(x+2y)/3+z=2/3 ③,联立①②③解得:x=y=z=1/3,则混合气体中含NO2的体积百分含量为1/3×100%≈33.3%。
N2O4,即混合气体是NO2、N2O4、NO,设生成1mol混合气体,三者的物质的量分别为xmol、ymol、zmol,x+y+z=1 ①,平均相对分子质量为56,得46x+92y+30z=56 ②,气体通过水后,体积缩小了1/3,即最后气体体积为2/3,1分子N2O4相当于2分子NO2,则根据方程式3NO2+H2O=2HNO3+NO可知(x+2y)/3+z=2/3 ③,联立①②③解得:x=y=z=1/3,则混合气体中含NO2的体积百分含量为1/3×100%≈33.3%。

练习册系列答案
相关题目
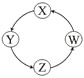
【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①④