题目内容
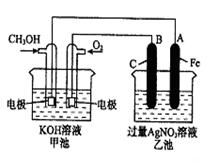
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是


| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体 |
D
甲池为原电池,作为电源,电解乙池、丙池两个电解池。根据原电池的形成条件,通入CH3OH的一极为负极,通入O2的一极为正极,所以石墨、Pt(左)作阳极,Ag、Pt(右)作阴极;B项,负极反应:CH3OH-6e-+8OH-=CO32-+6H2O;C项,应加入CuO;D项,丙池中:MgCl2+2H2OMg(OH)2↓+Cl2↑+H2↑,消耗0.0125 mol O2,转移0.05 mol电子,生成0.025 mol Mg(OH)2,其质量为1.45 g。答案选D。

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
 Li2CoO2,下列说法不正确的是
Li2CoO2,下列说法不正确的是