题目内容
【题目】现有如下溶液:
①1.0mL0.10molL-1双氧水
②1.0mL0.20molL-1双氧水
③3.0mL0.10molL-1KMnO4溶液
④3.0mL0.010molL-1KMnO4溶液。
所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
(1)写出发生反应的离子方程式_________________________;若某反应的化学方程式为2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2↑+12H2O,则该反应的氧化剂为______________,若有9molH2O2参加该反应,则反应转移电子数目为___________;
(2)某温度下,若要探究反应物浓度对反应速率的影响,则应选择试剂______进行实验(填序号)。
(3)某温度下,某同学按照(2)中选择试剂进行实验,褪色时间为5s:
①计算以H2O2表示的反应速率为___________;
②进行实验过程中,该同学发现颜色变化会出现先慢后快并突然褪色的现象。为此该同学又进行了一次平行实验,只是加入少量MnSO4固体,结果溶液立即褪色,请推测颜色变化会出现先慢后快并突然褪色的现象的原因___________;
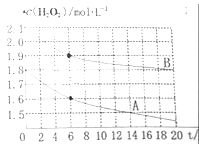
(4)某同学在不同温度下,分别取两份等体积不同浓度的双氧水与等量KMnO4溶液进行反应,绘制出c(H2O2)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则_____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是___________;
【答案】(1)2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O KMnO4、H2O2 14NA
(2)①②④ (3)①3.0×10-3mol·L-1·S-1 ②生成的MnSO4为该反应的催化剂
(4)A A曲线起始浓度小,但在0~6s内平均反应加快,说明其温度高
【解析】
试题分析:现有如下溶液:①1.0mL0.10molL-1双氧水 ②1.0mL0.20molL-1双氧水 ③3.0mL0.10molL-1KMnO4溶液 ④3.0mL0.010molL-1KMnO4溶液。所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
(1)KMnO4溶液氧化H2O2,发生反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;在反应2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2↑+12H2O中,KMnO4降低的化合价总数为10,生成氧气共升高14价,结合化合价升降总数相等,可知另有部分H2O2作氧化剂,则该反应的氧化剂为KMnO4、H2O2,若有9molH2O2参加该反应,转移电子的物质的量为14mol,即转移电子数目为14NA;
(2)恒温度下,应选择①②④三种试剂来探究反应物浓度对反应速率的影响;
(3)①根据选择的试剂,当褪色时间为5s是以H2O2表示的反应速率为3.0×10-3mol·L-1·S-1;
②只少量MnSO4固体,结果溶液立即褪色,说明是MnSO4反应催化剂,这是反应溶液颜色变化会出现先慢后快并突然褪色的根本原因;
(4)温度对反应速率的影响远大于浓度对反应速率的影响,且温度越高,反应速率越快,由此可知曲线A所对应的实验温度高,因为A曲线起始浓度小,但在0~6s内平均反应加快,故说明其温度高。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。