题目内容
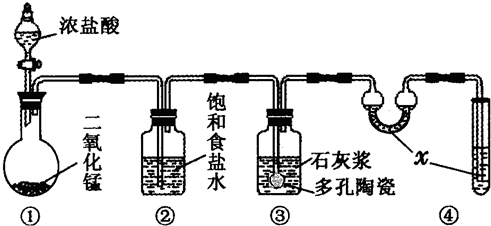
在实验室中,某研究性学习小组利用下列装置制备漂白粉,并进行有关实验探究
(1)装置④中的x试剂为______.
(2)装置③中发生反应的化学方程式为______.该反应是放热反应,反应温度较高时有副反应发生.改进该实验装置以减少副反应发生的方法是______.
[探究一]测定漂白粉有效成分的质量分数
称取1.000g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000mol?L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3ClO-+I-=3Cl-+IO3- IO3-+5I-+3H2O=6OH-+3I2实验测得数据如下表所示.
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
[探究二]研究漂白粉用于鱼塘消毒过程中有效氯含量的变化规律研究性学习小组模拟鱼塘环境,进行有关实验.
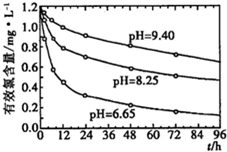
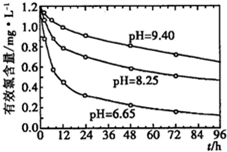
(4)研究不同的pH对漂白粉有效氯含量的影响,结果如图所示.从图中可得到的有关结论是______(写出其中一个).

(5)为研究温度对漂白粉有效氯含量的影响,请简述你的实验设计方案:______.
【答案】分析:(1)根据氯气的物理性质和化学性质判断试剂.
(2)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,根据温度对该反应的影响分析.
(3)先计算次氯酸钙的质量,再根据质量分数公式计算;根据使用碘化钾的物质的量判断测定结果.
(4)根据图象分析,PH值与漂白粉有效氯衰减速率之间的关系分析.
(5)设计实验时,其它条件相同,只有温度不同,判断温度与漂白粉有效氯含量的关系.
解答:解:(1)氯气有毒,所以不能直接排空;氯气能和氢氧化钠溶液反应生成氯化钠和次氯酸钠、水,所以有毒物质转变为无毒物质,所以x试剂为氢氧化钠溶液.
故答案为:NaOH溶液.
(2)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;该反应是放热反应,反应温度较高时有副反应发生.改进该实验装置以减少副反应发生的方法是降低温度.
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;将装置③置于冷水浴中进行实验.
(3)3ClO-+I-=3Cl-+IO3- ①; IO3-+5I-+3H2O=6OH-+3I2②
将方程式①+②得:ClO-+2I-+H2O=Cl-+2OH-+I2
KI溶液的总体积=(19.98+20.02+20.00)mL=60.00mL.
设次氯酸根离子的物质的量为x.
ClO-+2I-+H2O=Cl-+2OH-+I2
1mol 2mol
x 0.1000mol?L-1×0.060L
所以x=0.003mol
次氯酸钙的质量为:143g× ×0.003mol=0.2145g
×0.003mol=0.2145g
所以质量分数为: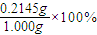 =21.45%;
=21.45%;
若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,导致碘化钾的物质的量偏少,所以测定结果将 偏低.
故答案为:21.45%;偏低.
(4)根据图象分析得,pH越小,漂白粉有效氯衰减速率越快.
故答案为:pH越小,漂白粉有效氯衰减速率越快.
(5)设计实验时,其它条件必须相同,只有温度不同,根据不同温度和不同时间漂白粉有效氯含量找出其关系.
故答案为:在浓度、pH均相同的条件下,测定不同温度下.不同时间的漂白粉有效氯含量.
点评:本题考查了氯气的性质及实验的设计,难度较大,会根据要求设计实验,是学习的难点和考试的热点.
(2)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,根据温度对该反应的影响分析.
(3)先计算次氯酸钙的质量,再根据质量分数公式计算;根据使用碘化钾的物质的量判断测定结果.
(4)根据图象分析,PH值与漂白粉有效氯衰减速率之间的关系分析.
(5)设计实验时,其它条件相同,只有温度不同,判断温度与漂白粉有效氯含量的关系.
解答:解:(1)氯气有毒,所以不能直接排空;氯气能和氢氧化钠溶液反应生成氯化钠和次氯酸钠、水,所以有毒物质转变为无毒物质,所以x试剂为氢氧化钠溶液.
故答案为:NaOH溶液.
(2)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;该反应是放热反应,反应温度较高时有副反应发生.改进该实验装置以减少副反应发生的方法是降低温度.
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;将装置③置于冷水浴中进行实验.
(3)3ClO-+I-=3Cl-+IO3- ①; IO3-+5I-+3H2O=6OH-+3I2②
将方程式①+②得:ClO-+2I-+H2O=Cl-+2OH-+I2
KI溶液的总体积=(19.98+20.02+20.00)mL=60.00mL.
设次氯酸根离子的物质的量为x.
ClO-+2I-+H2O=Cl-+2OH-+I2
1mol 2mol
x 0.1000mol?L-1×0.060L
所以x=0.003mol
次氯酸钙的质量为:143g×
 ×0.003mol=0.2145g
×0.003mol=0.2145g所以质量分数为:
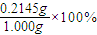 =21.45%;
=21.45%;若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,导致碘化钾的物质的量偏少,所以测定结果将 偏低.
故答案为:21.45%;偏低.
(4)根据图象分析得,pH越小,漂白粉有效氯衰减速率越快.
故答案为:pH越小,漂白粉有效氯衰减速率越快.
(5)设计实验时,其它条件必须相同,只有温度不同,根据不同温度和不同时间漂白粉有效氯含量找出其关系.
故答案为:在浓度、pH均相同的条件下,测定不同温度下.不同时间的漂白粉有效氯含量.
点评:本题考查了氯气的性质及实验的设计,难度较大,会根据要求设计实验,是学习的难点和考试的热点.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol?L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法错误的是( )
| A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | B、如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶 | C、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 | D、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色 |
在实验室中,某研究性学习小组利用下列装置制备漂白粉,并进行有关实验探究 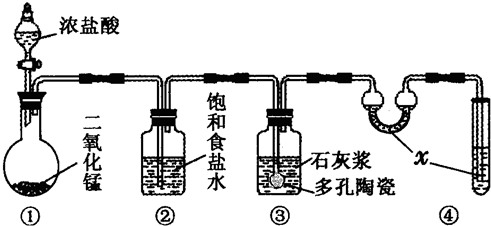
(1)装置④中的x试剂为______.
(2)装置③中发生反应的化学方程式为______.该反应是放热反应,反应温度较高时有副反应发生.改进该实验装置以减少副反应发生的方法是______.
[探究一]测定漂白粉有效成分的质量分数
称取1.000g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000mol?L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3ClO-+I-=3Cl-+IO3- IO3-+5I-+3H2O=6OH-+3I2实验测得数据如下表所示.
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
[探究二]研究漂白粉用于鱼塘消毒过程中有效氯含量的变化规律研究性学习小组模拟鱼塘环境,进行有关实验.
(4)研究不同的pH对漂白粉有效氯含量的影响,结果如图所示.从图中可得到的有关结论是______(写出其中一个).
(5)为研究温度对漂白粉有效氯含量的影响,请简述你的实验设计方案:______.