题目内容
【题目】Ⅰ.运用已学知识完成下列计算:
(1)0.5 mol CH4的质量是________,在标准状况下的体积为________。
(2)3.1 g Na2X含有Na+ 0.1 mol,则X的相对原子质量为________。
Ⅱ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是_____。
(2)当有3mol I2生成时,有______mol还原剂被氧化。
(3)用双线桥表示该反应电子转移的方向和数目_______________________。
【答案】8g 11.2L 16 KIO3 I2 5 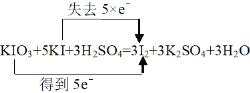
【解析】
Ⅰ⑴0.5 mol CH4的质量是![]() ,在标准状况下的体积为
,在标准状况下的体积为![]() ,故答案为:8g;11.2L;
,故答案为:8g;11.2L;
⑵3.1 g Na2X含有Na+ 0.1 mol,则Na2X的物质的量为0.05mol,则Na2X的摩尔质量为![]() ,23×2 + Mr(X) = 62,Mr(X)=16,因此X的相对原子质量为16,故答案为16;
,23×2 + Mr(X) = 62,Mr(X)=16,因此X的相对原子质量为16,故答案为16;
Ⅱ.⑴KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O中碘酸钾中碘化合价降低,碘化钾中碘化合价升高,单质碘既是升高得到的产物,又是降低得到的产物,因此既是氧化产物又是还原产物,因此该反应中,氧化剂是KIO3,氧化产物是I2;故答案为:KIO3;I2;
⑵KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,有3mol I2生成时,有1mol KIO3被还原,有5mol KI被氧化,因此当有3mol I2生成时,有5 mol还原剂被氧化,故答案为:5;
⑶用双线桥表示该反应电子转移的方向和数目 ,故答案为:
,故答案为: 。
。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案