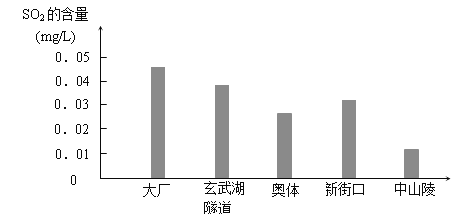
ЬтФПФкШн
ЁОЬтФПЁПМзДМЪЧвЛжжПЩдйЩњЕФЧхНрФмдД,вЛЖЈЬѕМўЯТгУCOКЭH2КЯГЩCH3OH:COЃЈgЃЉ+2H2 ЃЈgЃЉ![]() CH3OHЃЈgЃЉH =a kJЁЄmol-1ЁЃЯђЬхЛ§ЮЊ2 LЕФУмБеШнЦїжаГфШы2mol COКЭ4mol H2ЃЌВтЕУВЛЭЌЮТЖШЯТШнЦїФкЦјЬхзмЮяжЪЕФСПЫцЪБМфЃЈminЃЉЕФБфЛЏЙиЯЕШчЯТзѓЭМжаЂёЁЂЂђЁЂЂѓЧњЯпЫљЪОЃК
CH3OHЃЈgЃЉH =a kJЁЄmol-1ЁЃЯђЬхЛ§ЮЊ2 LЕФУмБеШнЦїжаГфШы2mol COКЭ4mol H2ЃЌВтЕУВЛЭЌЮТЖШЯТШнЦїФкЦјЬхзмЮяжЪЕФСПЫцЪБМфЃЈminЃЉЕФБфЛЏЙиЯЕШчЯТзѓЭМжаЂёЁЂЂђЁЂЂѓЧњЯпЫљЪОЃК
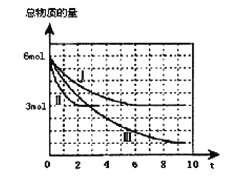
ЃЈ1ЃЉФмХаЖЯЗДгІДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧ ЃЈЬюзжФИЃЉЁЃ
AЃЎcЃЈCOЃЉгыcЃЈH2ЃЉЕФБШжЕБЃГжВЛБф
BЃЎШнЦїжаЦјЬхбЙЧПБЃГжВЛБф
CЃЎШнЦїжаЦјЬхУмЖШБЃГжВЛБф
DЃЎЕЅЮЛЪБМфФкга1molCOЯћКФЕФЭЌЪБга1mol CH3OHЩњГЩ
EЃЎvе§ЃЈH2ЃЉЃН2 vФцЃЈCH3OHЃЉ
ЃЈ2ЃЉЂйЂђКЭЂёЯрБШЃЌЂђИФБфЕФЗДгІЬѕМўЪЧ ЁЃ
ЂкЗДгІЂѓдк9minЪБДяЕНЦНКтЃЌБШНЯЗДгІЂёЕФЮТЖШЃЈT1ЃЉКЭЗДгІЂѓЕФЮТЖШЃЈT3ЃЉЕФИпЕЭЃКT1 T3ЃЈЬюЁА>ЁБЁА<ЁБЁА=ЁБЃЉЃЌДЫе§ЗДгІЪЧ________ЗДгІЃЈЬюЁАЗХШШЛђЮќШШЁБЃЉЁЃ
ЃЈ3ЃЉЂйЗДгІЂёдк6 minЪБДяЕНЦНКтЃЌДгЗДгІПЊЪМЕНДяЕНЦНКтЪБv ЃЈCH3OHЃЉ = mol/ЃЈLЁЄminЃЉЁЃ
ЂкЗДгІЂђдк2 minЪБДяЕНЦНКтЃЌМЦЫуИУЮТЖШЯТЕФЦНКтГЃЪ§K= ЁЃдкЬхЛ§КЭЮТЖШВЛБфЕФЬѕМўЯТЃЌдкЩЯЪіЗДгІДяЕНЦНКтЂђЪБЃЌдйЭљШнЦїжаМгШы1 mol COКЭ3 mol CH3OHКѓЃЌЦНКтНЋЯђ_________ЃЈЬюЁАе§ЗДгІЁЂФцЗДгІКЭВЛвЦЖЏЁБЃЉЃЌдвђЪЧ______________ЁЃ
ЁОД№АИЁПЃЈ1ЃЉBE
ЃЈ2ЃЉЂйЪЙгУДпЛЏМСЃЛЂк>ЃЛЗХШШ
ЃЈ3ЃЉЂй1/8Лђеп0.125mol/ЃЈL.minЃЉЃЛ
Ђк12ЃЛВЛвЦЖЏЃЛвђЮЊЦНКтЂђКѓЃЌМгШы1molCOЁЂ3molCH3OHЃЌ
ДЫЪБ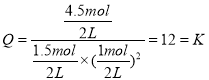 ЃЌЫљвдЦНКтВЛвЦЖЏ
ЃЌЫљвдЦНКтВЛвЦЖЏ
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉЭЖСЯБШЕШгкЯЕЪ§БШЃЌcЃЈCOЃЉгыcЃЈH2ЃЉЕФБШжЕЪЧЖЈжЕЃЌcЃЈCOЃЉгыcЃЈH2ЃЉЕФБШжЕБЃГжВЛБфВЛвЛЖЈЦНКтЃЛЗДгІЧАКѓЦјЬхЯЕЪ§КЭВЛЭЌЃЌбЙЧПЪЧБфСПЃЌШнЦїжаЦјЬхбЙЧПБЃГжВЛБфвЛЖЈЦНКтЃЛЕЅЮЛЪБМфФкга1molCOЯћКФЕФЭЌЪБга1mol CH3OHЩњГЩЃЌЖМЪЧе§ЗДгІЫйТЪЃЌЫљвдВЛвЛЖЈЦНКтЃЛе§ФцЗДгІЫйТЪБШЕШгкЯЕЪ§БШЃЌvе§ЃЈH2ЃЉЃН2 vФцЃЈCH3OHЃЉвЛЖЈЦНКтЃЛЃЈ2ЃЉЂйЂђКЭЂёЯрБШЃЌЗДгІЫйТЪМгПьЃЌЦНКтВЛвЦЖЏЃЌЂђИФБфЕФЗДгІЬѕМўЪЧМгШыДпЛЏМСЃЛЂкЗДгІЂѓЕФЫйТЪТ§ЃЌЗДгІЂѓЕФЮТЖШЕЭЃЌT1 >T3ЃЛНЕЕЭЮТЖШЦНКте§ЯђвЦЖЏЃЌе§ЗДгІЗХШШЃЛЃЈ3ЃЉ ЂйИљОнЬтвтЃЌЩшЩњГЩМзДМЕФЮяжЪЕФСПЮЊxmol

2-x+4-2x+x=3НтЕУX=1.5mol
v ЃЈCH3OHЃЉ=1.5molЁТ2 LЁТ6 min=0.125 mol/ЃЈL.minЃЉЃЛ
Ђк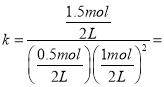 12ЃЛ
12ЃЛ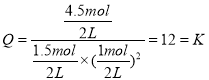 ЫљвдЦНКтВЛвЦЖЏЁЃ
ЫљвдЦНКтВЛвЦЖЏЁЃ